
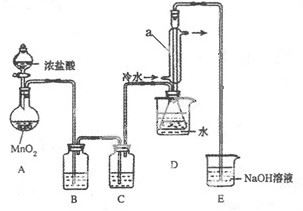
(9分)一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成。某校化学研究性学习小组从定性方面对此作了研究。
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。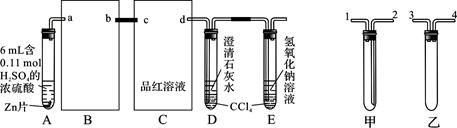
试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中CCl4的作用是________________________。
(2)能证明浓硫酸具有强氧化性的实验现象为_______________________________;实验过程中,浓硫酸表现强氧化性的反应方程式是:
____________________________________________________________________
(3)反应较长时间后气泡量又会明显增加的原因是________________________________
____________________________________。
(1)3(或4)、4(或3)(1分); 2、1(1分);防止倒吸(1分);
(2)C中品红溶液褪色(2分);Zn+2H2SO4=ZnSO4+SO2↑+2H2O(2分);
(3)浓H2SO4变成稀H2SO4,与Zn反应放出H2(2分);
解析试题分析:(1)B的作用是防止倒吸,可将乙填入B中;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,DE中的四氯化碳可以防止气体吸收时倒吸;故答案为:3(或4);4(或3); 2; 1;防止倒吸。
(2)有二氧化硫生成能证明浓硫酸具有强氧化性,二氧化硫能使品红褪色,所以能证明浓硫酸具有强氧化性的实验现象为:C中品红溶液褪色;H2SO4中S元素化合价由+6价降低到+4价,所以浓硫酸表现强氧化性的反应方程式是:Zn+2H2SO4=ZnSO4+SO2↑+2H2O。
(3)随反应进行,H2SO4的浓度逐渐减小,浓H2SO4变成稀H2SO4,与Zn反应放出H2。
考点:本题考查实验方案的设计与分析、化学方程式的书写。


科目:高中化学 来源: 题型:填空题
金刚石SiC具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物H为非极性分子,碳元素在周期表中的位置是,Q是,R的电子式为.
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为,除去粗产品中少量钠的试剂为.
(3)碳还原制SiC,其粗产品中杂质为Si和SiO2.先将20.0g 粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为,硅酸钠的物质的量浓度为
粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为,硅酸钠的物质的量浓度为
(4)下列叙述正确的有(填序号),ks5u
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应②水晶、干冰熔化时克服粒子间作用力的类型相同③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下: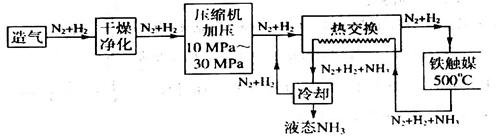
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
氨气是化学工业上应用非常广泛的物质。下面仅是它在两方面的重要用途。
“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水)。
| | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
 (4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:| b∕a的取值范围 | 溶质 | 溶质物质的量 |
| | | |
 | —— | —— |
| | | |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: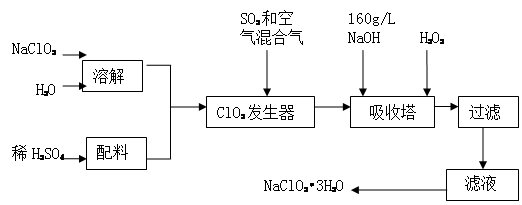
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1) 160 g/L NaOH溶液的物质的量浓度为 。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2
外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6) 从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2?3H2O晶体必须进行的操作是 (填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)(原创)硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,则试剂甲为:
。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、
。(用离子方程式表示)
②装置B、D的作用是 。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为: →g,h→ , → , →d。
(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程
式为: 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置: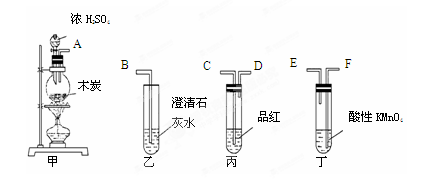
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化合价升高,另一部分化合价降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2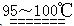 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。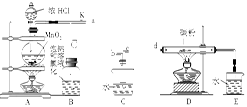
(1)要将C装置接入B和D之间,正确的接法是:a→ → →d。
(2)实验开始先点燃A处的酒精灯,打开阀K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为 。
(3)D处反应完毕后,关闭阀K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是 ,B的作用是 。
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并画出改进后的装置图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com