
����Ŀ����ѧʵ�����������⻯ѧ֪ʶ���γɻ�ѧ������̽���봴��������������ѧ������
��1����ʵ��������Ũ������MnO2������ȡCl2���������ʵ�顣
�� ��ƽ���з���ʽ��
HCl(Ũ) + MnO2 ![]() MnCl2 + Cl2 + H2O___________
MnCl2 + Cl2 + H2O___________
�������ռ�Cl2����ȷװ����_______��
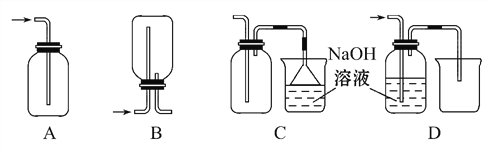
�� ��Cl2ͨ�뵽Ba(OH)2��Һ�з�����Ӧ�Ļ�ѧ����ʽΪ��______
�� ����������ȼ�յĻ�ѧ����ʽΪ��______________
�� ������������ˮ���뵽ʢ������NaHCO3��ĩ���Թ��У��ɿ��������У� ____
���𰸡� 4HCl(Ũ)+MnO2![]() MnCl2+Cl2��+2H2O C 2Ba(OH)2+2Cl2=BaCl2+Ba(ClO)2+2H2O 2Fe+3Cl2
MnCl2+Cl2��+2H2O C 2Ba(OH)2+2Cl2=BaCl2+Ba(ClO)2+2H2O 2Fe+3Cl2![]() FeCl3 ��ˮ��ɫ��dz����ɫ����ĩ�ܽ⣻�����ݲ���
FeCl3 ��ˮ��ɫ��dz����ɫ����ĩ�ܽ⣻�����ݲ���
����������1������Ԫ�ػ��ϼ۴ӣ�1�����ߵ�0�ۣ���Ԫ�ػ��ϼ۴�+4�۽��͵�+2�ۣ����Ը��ݵ��ӵ�ʧ�غ㡢ԭ���غ��֪����ʽΪ4HCl(Ũ)+MnO2![]() MnCl2+Cl2��+2H2O���������ܶȴ��ڿ�����������ˮ��Ӧ���������ſ������ռ�������Ϊ�����ж�����Ҫβ������������������������Һ���ն����������ͬʱҪע���ֹ��������ѡC���۽�Cl2ͨ�뵽Ba(OH)2��Һ�з�����Ӧ�Ļ�ѧ����ʽΪ2Ba(OH)2+2Cl2=BaCl2+Ba(ClO)2+2H2O��������������ȼ�յĻ�ѧ����ʽΪ2Fe+3Cl2
MnCl2+Cl2��+2H2O���������ܶȴ��ڿ�����������ˮ��Ӧ���������ſ������ռ�������Ϊ�����ж�����Ҫβ������������������������Һ���ն����������ͬʱҪע���ֹ��������ѡC���۽�Cl2ͨ�뵽Ba(OH)2��Һ�з�����Ӧ�Ļ�ѧ����ʽΪ2Ba(OH)2+2Cl2=BaCl2+Ba(ClO)2+2H2O��������������ȼ�յĻ�ѧ����ʽΪ2Fe+3Cl2![]() FeCl3����������ˮ��Ӧ���ɵ���������̼�����Ʒ�Ӧ�ų�������̼��������������ˮ���뵽ʢ������NaHCO3��ĩ���Թ��У��ɿ�����������ˮ��ɫ��dz����ɫ����ĩ���ܽ⣬�����ݲ�����
FeCl3����������ˮ��Ӧ���ɵ���������̼�����Ʒ�Ӧ�ų�������̼��������������ˮ���뵽ʢ������NaHCO3��ĩ���Թ��У��ɿ�����������ˮ��ɫ��dz����ɫ����ĩ���ܽ⣬�����ݲ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ʵ�飬�Լ��鷴Ӧ�е������仯��
ʵ���з��ַ�Ӧ��a�����¶����ߣ��ɴ˿����жϣ�a���з�Ӧ��________�ȷ�Ӧ����b�����¶Ƚ��ͣ����������غ㶨�ɣ���b���з�Ӧ���������Ӧ��________�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ���뻹ԭ������ʵ�ֵ���
A. S2-��H2S B. HCO3-��CO2�� C. 2Cl-��Cl2 D. Cu2+��Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.5L��AlCl3��Һ����μ���ijŨ�ȵ�NaOH��Һ���õ��ij�����NaOH��Һ����ı仯��ͼ��ʾ�����н����ȷ���ǣ� �� 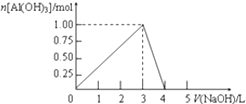
A.��Ӧ�����У��������ʱ������Ϊ7.8g
B.AlCl3��Һ��Ũ��Ϊ2.0 molL��1
C.�õ�39g����ʱ�����ĵ�NaOH��Һ���һ��Ϊ1.5 L
D.��V��NaOH��=4.0 Lʱ���õ�����Һ�к�Na+��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.ʯ�͵Ĵ�������ú�ĸ�������Եõ���������˵��ʯ�ͺ�ú�к��з�����
B.ʯ���ѽ��Ŀ����Ҫ��Ϊ�˵õ����������
C.ʯ�ͷ���õ��IJ����������ȡ��ˮ�е���
D.ʯ���ѻ���Ҫ�õ�������ϩ����ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���д���������Ԫ�ص�ѭ������ͼ��ʾѭ����Ԫ����(����)

A. �� B. ̼ C. �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������߲࣬�ԣ�ͼA������ȡ����ʱ����Ϊ߲����߲�����ĸ���ԭ������������ӽ������Ҷ���أ�ͼB���ȶ������ʣ���ش�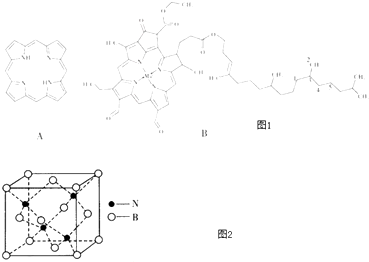
��1��߲����Nԭ�Ӳ��õĹ���ӻ���ʽ��
��2�������й�Ҷ���ط��ӵ�˵����ȷ��������ѡ����ţ���
A.ͼ1��1��5��C����������������
B.�����д�����λ��
C.ͼ1��1��2��3��4��C����
D.N�ĵ�һ�����ܴ���O
��3��߲����Fe2+�ϼ����γ�Ѫ���أ�Fe2+�ĵ����Ų�ʽΪ
��4���軯�⣨HCN����һ�ֺ����綾�����������ЦҼ���м��ĸ�����Ϊ �� �ɷ��ӽṹ�Ʋ⣬�軯������ס����ס�������ˮ��ԭ���� �� �軯���������������CN����ʹ��Ѹ���ж�����ٳ�����CN���ĵȵ����� ��
��5��N��B�ܹ��γ�һ��Ӳ�Ƚӽ����ʯ�����ʣ��侧��ṹ��ͼ2�����侧���߳�Ϊapm�������ܶ�Ϊg��cm��3��ֻ����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��ʵ���ϰ��������ͻ�ԭ�������̡�������һ����ԭ���̵ķ�Ӧʽ:NO3-+4H++3e-![]() NO+2H2O,KMnO4��Na2CO3��Cu2O��Fe2(SO4)3���������е�һ������(��)��ʹ������ԭ���̷�����
NO+2H2O,KMnO4��Na2CO3��Cu2O��Fe2(SO4)3���������е�һ������(��)��ʹ������ԭ���̷�����
��1��д������ƽ��������ԭ��Ӧ�ķ���ʽ:_____________________��
��2����Ӧ������������_____��_____���ʡ�
��3������Ӧ��ת�Ƶĵ�������Ϊ0.15 NA(NA�ǰ����ӵ�������ֵ),�������NO�ڱ�״���µ������_____ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɡ���ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������̼��Ԫ����C��Si�ķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�������ͼ2װ������֤±��Ԫ�����ʵĵݱ���ɡ�A��B��C�����ֱ���մ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ���ֽ����֪������Ũ�������������ܷ�Ӧ����������

��1��д����Ӧװ����ѡ�õ����ʣ�A______________________��B________________��C________________��
��2������װ��B����ʢ�Լ�������Ϊ___________________��C�з�Ӧ�����ӷ���ʽΪ_______________________________��
��3����ͬѧ��ʵ��ԭ����________________________________________________��д��B�������ӷ���ʽ��________________________________��
���𰸡� ʯ��ʯ(CaCO3) ����NaHCO3��Һ Na2SiO3��Һ ��ȥCO2�е�HCl���� SiO��2CO2��2H2O===H2SiO3����2HCO-(CO2����) ǿ����������������������õķǽ��������û��ϲ����õķǽ������� 2I����Cl2===2Cl����I2��Br2��2I��===I2��2Br��
�����������������ͨ���Ƚ�����ǿ�����жϷǽ�����ǿ�������C��Si�ķǽ�����ǿ���Ƚϵ�ʵ�飬Aװ����ȡ������̼��Bװ�ó�ȥ������̼�е��Ȼ��⣬Cװ�ù������������̼��Ӧ֤��̼������Դ��ڹ����ͨ���Ƚϵ��ʵ����������жϷǽ����ԡ�
�������������Ϸ�����(1). ���C��Si�ķǽ�����ǿ���Ƚϵ�ʵ�飬Aװ����ȡ������̼��Bװ�ó�ȥ������̼�е��Ȼ��⣬Cװ�ù������������̼��Ӧ֤��̼������Դ��ڹ��װ����ѡ�õ����ʣ�A�з�ʯ��ʯ��B��ʢ�ű���NaHCO3��Һ��C��ʢ��Na2SiO3��Һ����2��װ��B��ʢ����NaHCO3��Һ�������dz�ȥCO2�е�HCl���壻C�й����������������̼��Ӧ���ɹ��������̼�����ƣ����ӷ���ʽΪSiO��2CO2��2H2O===H2SiO3����2HCO-����3����ͬѧͨ���Ƚϵ��ʵ����������жϷǽ����ԣ�ʵ��ԭ����ǿ����������������������õķǽ��������û��ϲ����õķǽ���������B�����뷴Ӧ��������������A�����ɵ���������������⻯�ط�Ӧ�����Ȼ��غ͵ⵥ�ʵ����ӷ���ʽ��2I����Cl2===2Cl����I2������⻯�ط�Ӧ�����廯�غ͵ⵥ�ʵ����ӷ���ʽ��Br2��2I��===I2��2Br��
�����͡�ʵ����
��������
21
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������͵�ء����װ����ͼ��ʾ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ���

��ش��������⣺
��1���ڵ����е�����������Ϊ______________(��a��b��ʾ)��
��2��������ӦʽΪ__________________��
��3���缫����Ʋ��۵�ԭ����__________________________________��
��4���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ��������ϵ��ṩ���ܡ���˴�����ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
��.2Li��H2��2LiH
��.LiH��H2O===LiOH��H2��
�ٷ�Ӧ���еĻ�ԭ����__________����Ӧ���е���������__________��
����֪LiH�����ܶ�Ϊ0.82 g/cm3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2���֮��Ϊ________��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ__________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com