
| A.多余的氧气中 |
| B.生成的三氧化硫中 |
| C.氧气和二氧化硫中 |
| D.二氧化硫、氧气和三氧化硫中 |
科目:高中化学 来源:不详 题型:单选题
| A.熵变 | B.温度 | C.压强 | D.焓变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2 (g) + CO2(g)
H2 (g) + CO2(g)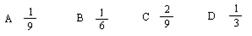
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容器中只有三氧化硫 |
| B.18O原子存在于氧气、二氧化硫、三氧化硫中 |
| C.生成2mol三氧化硫 |
| D.18O原子只存在于三氧化硫与氧气中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0molS02 | B.2molS03 | C.1mol02 | D.1molSO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 3 |
| 2 |
| 3 |
| 2 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 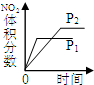 | 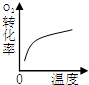 | 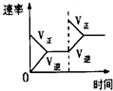 | 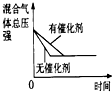 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 HCO3-+H+的平衡常数K1=______.(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=______.(已知:10-5.60=2.5×10-6)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 MgCl2 + 2Rb(g),对于此反应,能够进行正确解释的是 ( )
MgCl2 + 2Rb(g),对于此反应,能够进行正确解释的是 ( )| A.铷比镁金属性强 |
| B.氯化镁比氯化铷难溶 |
| C.高温下,镁离子得电子能力比铷离子弱 |
| D.铷的沸点比镁低,当把铷蒸气抽走时,平衡向右反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com