
| 3 |
| 2 |
| 3 |
| 2 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 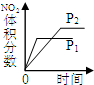 | 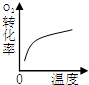 | 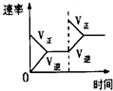 | 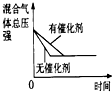 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| c2(NO2) |
| c2(NO)?c(O2) |
| 0.01-0.004 |
| 2 |
| 1 |
| 2 |
| c2(NO2) |
| c2(NO)?c(O2) |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.CO(g) +2H2(g)=CH3OH(g) |
| B.CaCO3(s)+2HCI(g)=CaCl2(s)+CO2(g)+H2O(l) |
| C.2H2(g)+O2(g)=2H2O(l) |
| D.2HgO(s)=2Hg(l)+O2(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.多余的氧气中 |
| B.生成的三氧化硫中 |
| C.氧气和二氧化硫中 |
| D.二氧化硫、氧气和三氧化硫中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2为0.2mol/L,H2为0.6mol/L |
| B.N2为0.15mol/L |
| C.N2、H2均为0.18mol/L |
| D.NH3为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
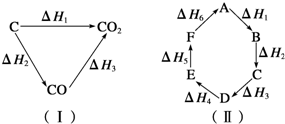
| A.A→F△H=-△H6 |
| B.A→D△H=△H1+△H2+△H3 |
| C.△H1+△H2+△H3+△H4+△H5+△H6=0 |
| D.△H1+△H6=△H2+△H3+△H4+△H5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 3 |
| 2 |
| A.-2491kJ?mol-1 | B.+859kJ?mol-1 |
| C.-1403kJ?mol-1 | D.-859kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 1 |
| 2 |
| 1 |
| 2 |
| A.吸热88kJ | B.吸热44kJ |
| C.放热44kJ | D.吸热2.44kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应中化学能只能转化为热能 |
| B.可逆反应达到平衡后,正、逆反应速率均为0 |
| C.SO2和O2反应达到平衡后,无SO2或O2剩余 |
| D.化学反应中一定有化学键的断裂和生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com