
| △c |
| △t |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.7mol/L |
| 4min-2min |
| 1.82 |
| 0.1×1.22 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
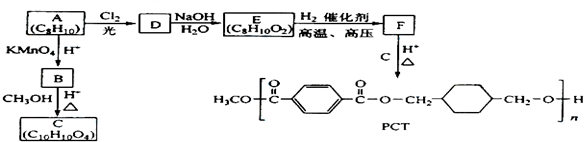
查看答案和解析>>
科目:高中化学 来源: 题型:
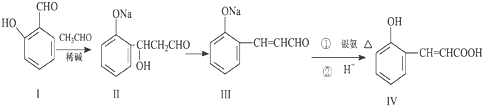
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、h1>h2>h3>h4 |
| B、h4>h3>h1>h2 |
| C、h4>h1>h3>h2 |
| D、h2>h3>h1>h4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
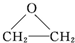 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )| A、可使酸性KMnO4溶液褪色 |
| B、可使溴水褪色 |
| C、一定条件下,可用H2除去乙烷中的X |
| D、与丙烯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com