
【题目】(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化剂及军事科学中。所谓“纳米材料”是指研究、开发出的微粒直径从几纳米到几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 _______________________。
A.所得液体能全部透过半透膜 B.能全部透过滤纸
C.有丁达尔效应 D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,鉴别溶液和淀粉胶体可以利用的方法是______________。
(3)把少量的FeCl3饱和溶液滴入沸水中,制成Fe(OH)3胶体,制备氢氧化铁胶体的化学方程式为_____________________,向氢氧化铁胶体中滴入稀硫酸至稀硫酸过量可观察到的现象是_______________________________,写出上述反应的化学方程式___________________。
【答案】BC 用可见光照射后可观察是否有丁达尔效应,若有则为胶体 FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl 先有红褐色沉淀生成,后红褐色沉淀溶解,溶液变为棕黄色 2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O
Fe(OH)3(胶体)+3HCl 先有红褐色沉淀生成,后红褐色沉淀溶解,溶液变为棕黄色 2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O
【解析】
(1)由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,以此来解答;
(2)胶体具有丁达尔效应,而溶液不具备;
(3)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;向Fe(OH)3胶体中滴入稀硫酸,先发生胶体的聚沉,然后二者之间会发生复分解反应。
(1)分散系中分散质的直径在1nm~100nm之间的属于胶体分散系,由“纳米技术”是指粒子直径在几纳米到几十纳米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,则该混合物属于胶体,所以所得混合物可能具有的性质是胶体的性质;
A.胶体的分散质微粒较大,不能通过半透膜,故A错误;
B.胶体的分散质微粒较大,不能通过半透膜,但能透过滤纸,故B正确;
C.胶体都能产生丁达尔效应,故C正确;
D.胶体不是悬浊液,故D错误;
故答案为BC;
(2)胶体和溶液的区别是:胶体具有丁达尔效应,而溶液不具备,可以据此来鉴别二者,故用可见光照射胶体,观察有无“丁达尔现象”,有就是胶体;
(3)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;向Fe(OH)3胶体中滴入稀硫酸,胶体会发生聚沉,然后Fe(OH)3与硫酸发生复分解反应,沉淀又消失,发生反应的化学方程式为2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O。
Fe(OH)3(胶体)+3HCl;向Fe(OH)3胶体中滴入稀硫酸,胶体会发生聚沉,然后Fe(OH)3与硫酸发生复分解反应,沉淀又消失,发生反应的化学方程式为2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O。


科目:高中化学 来源: 题型:
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至SO42-沉淀完全:2H++ SO42-+Ba2++2OH==BaSO4↓+2H2O | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸:CO32- +2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O==Fe(OH)3↓+3H+ | 正确 |
D | 碳酸氢钠与足量澄清石灰水反应:2HCO3-+Ca2++2OH-==CaCO3↓+CO32-+2H2O | 正确 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20mL,浓度均为0.1mol/LHCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法正确的是
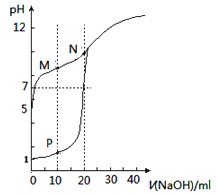
A. M点c(HX)-c(X-)>c(OH-)-c(H+)
B. N点的pH>7的原因是由于NaOH过量所致
C. HX为弱酸,且电离平衡常数Ka≈1×10-10
D. P点c(Cl-)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼方法中,属于热还原法的是( )
A. 2Ag2O![]() 4Ag+O2↑B. Fe+CuSO4===FeSO4+Cu
4Ag+O2↑B. Fe+CuSO4===FeSO4+Cu
C. Fe2O3+3CO![]() 2Fe+3CO2D. MgCl2(熔融)
2Fe+3CO2D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B和C为常见气体,A是所有气体中密度最小的气体;B是黄绿色气体;C能使湿润的红色石蕊试纸变蓝。D是目前用量最大,用途最广的金属。请回答下列问题:
(1)A是________(填化学式)
(2)实验室制取C时,常用________(填“向下”或“向上”)排空气法收集;
(3)B与D的单质在点燃条件下反应的化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
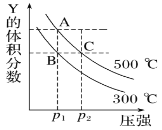
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H=___。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
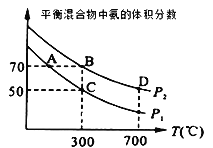
①恒压时,反应一定达到平衡状态的标志是___(填序号)
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C. ![]() 保持不变 D.
保持不变 D. ![]() =2
=2
②P1___P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___D点。
③C点H2的转化率为__;
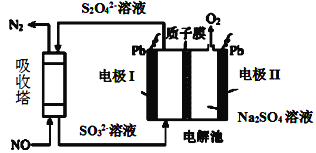
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 整个过程涉及一个复分解反应和两个氧化还原反应
D. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com