
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)硅是无机非金属材料的主角。请举出一种含硅元素的材料名称:__________。
(2)可以用浓氨水来检验氯气管道是否漏气,用此方法检查观察到的现象是___________。
(3)某校环保兴趣小组在处理污水样品时,需将质量分数为37%的浓盐酸(密度为1.19g·cm-3)配制成250mL0.1mol·L-1的盐酸。
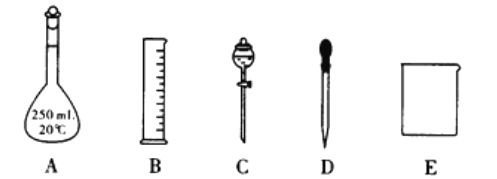
①在上图所示仪器中,配制上述溶原不需要的是________(填字母)。除图中已有仪器外,配制上述溶液还需要的玻璃仪器是_______________。
②若配制时其他操作均正确,烧杯没有洗涤,则所配溶液的物质的量浓度_________(填“偏高”,“偏低”或“无影响”,下同);定容时俯视,则所配溶液的物质的量浓度_______。
(4)铝制品表面因有一层氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏。若将氧化铝与氢氧化钠的溶液作用,反应的离子方程式为______________________。
(5)工业上用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,最好选用的试剂组合是__________(填字母)。
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
【答案】 玻璃、水泥、陶瓷、光导纤维等(任写一种即可) 产生白烟 C 玻璃棒 偏低 偏高 Al2O3+2OH-=2AlO2-+H2O bd
【解析】(1)硅是无机非金属材料的主角,含硅元素的材料很多,比如:玻璃、水泥、陶瓷、光导纤维等;正确答案:玻璃、水泥、陶瓷、光导纤维等(任写一种即可)。
(2)氯气与氨气反应生成氯化铵固体小颗粒,看到有白烟生成,正确答案:产生白烟。
(3)①配制成250mL0.1mol·L-1的盐酸,需要的仪器有A、 B、 D、 E、不需要C,除了已有仪器外,还需要玻璃棒进行搅拌、引流;正确答案:C ;玻璃棒。
②若配制时其他操作均正确,烧杯没有洗涤,造成溶质的量减少。则所配溶液的物质的量浓度偏低;定容时俯视,所加水的的量减少,溶液的体积偏小,则所配溶液的物质的量浓度偏高;正确答案:偏低;偏高 。
(4)氧化铝与氢氧化钠的溶液作用,生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;正确答案:Al2O3+2OH-=2AlO2-+H2O。
(5)Na2SiO3和NaAlO2混合溶液中加入足量的稀盐酸,生成硅酸沉淀,过滤,滤液为氯化铝、盐酸、氯化钠溶液,再向溶液中加入足量的氨水,过滤,得到氢氧化铝沉淀,正确选项 bd。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是:
A. 漂白粉被氧化了
B. 漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C. 有色布条被空气中的氧气氧化
D. 漂白粉溶液失去了部分水分,浓度增大了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是

A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:
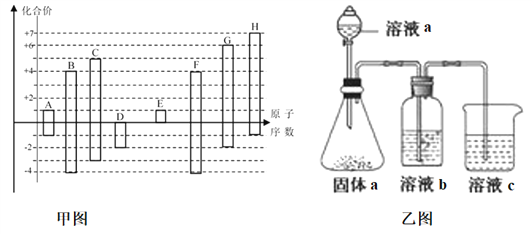
请回答下列问题:
(1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________ (写化学式),A和E形成的化合物的电子式为_____________。
(2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示)
(3)二元化合物X是含有C元素的18电子分子,1molX(l)在25℃ 101kPa下完全燃烧放出622kJ的热量,写出表示X燃烧热的热化学方程式________________________________。
(4)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式___________________________________。
(5)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为________,________(填化学式)。
②溶液c中的离子方程式为__________________________________________。
③请从原子结构的角度解释非金属性C>B的原因 ____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是生活中的一种常见金属,用途非常广泛。
(1)FeCl3溶液用于腐蚀铜制印刷电路板,发生反应的离子方程式为___________。
(2)废铁皮制取铁红粉的局部流程图如下:
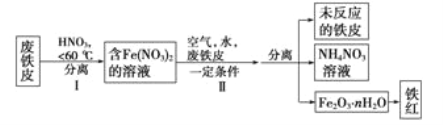
①步骤1温度不能太高的原因是____________________________。
②步骤Ⅱ中发生反应:
4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3
4Fe+10HNO3==4Fe( NO3)2+NH4NO3+3H20
第一个反应的氧化剂是___________,氧化产物是____________。第二个反应每生成1 molNH4NO3,转移的电子数是_________。
③铁红可用于焊接钢轨,其反应的化学方程式为_______________。
④上述生产结束后,流程中氮元素最主要的存在形式为__________(填字母)。
A.氮氧化物 B.硝酸铵 C.硝酸亚铁 D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体成分。
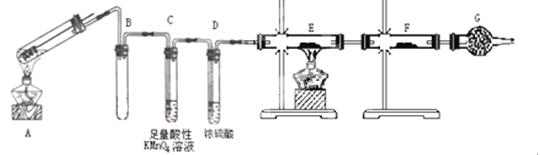
(1)填写装置的作用:B___________,C___________,G___________。
(2)证明有S02生成的实验现象是_____________________。
(3)可以证明所产生的气体中含有H2的实验现象是:E中:___________,F中:_________。如果去掉装置D,还能否根据F中的现象判断气体中有H2?_________(填能”或“不能”),原因是_________________________。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中Fe2+的方法是____________。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体。原因是___________________________;要确认有CuSO4生成,待试管冷却后,____________。写出铜与浓硫酸反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1,若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于煤、石油、天然气等资源的说法正确的是( )
A. 石油裂解得到的汽油是纯净物
B. 石油产品都可用于聚合反应
C. 天然气是一种清洁的化石燃料
D. 水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com