
【题目】主族元素X、Y、Z、M、N的原子序数依次增大,X、Z和M分属于不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子。
(1)五种元素中第一电离能最小的是________,电负性最大的是________。(填元素符号)
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是________。气态分子YM2的立体构型为________,YM2可形成多聚体(YM2)n的原因是________________。
(3)Z和N形成分子W的结构如图所示,化合物W的分子式为________,Z、N原子的杂化类型分别为________、________。

(4)已知化合物NX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成W,此反应是检验微量NX3的方法,该反应的化学方程式是________________________________________________________________________。
(5)画出配离子YZ4X![]() 的结构式:________,1 mol该离子中含有的共价键数目为__________。
的结构式:________,1 mol该离子中含有的共价键数目为__________。
【答案】 Be O ![]() 铍 直线形 BeCl2分子中Be与另外两个 BeCl2分子的Cl原子形成配位键 As4O6 sp3 sp3 4AsH3+24AgNO3+6H2O===As4O6+24Ag↓+24HNO3
铍 直线形 BeCl2分子中Be与另外两个 BeCl2分子的Cl原子形成配位键 As4O6 sp3 sp3 4AsH3+24AgNO3+6H2O===As4O6+24Ag↓+24HNO3 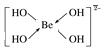 8NA
8NA
【解析】试题分析:主族元素X、Y、Z、M、N的原子序数依次增大,X、Z和M分属于不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,则Y只有2个能层且每个能层都有2个电子,所以Y为铍元素、X为氢元素;Z原子最外层电子数是次外层的3倍,则Z为氧元素、M为氯元素;N元素原子的4p轨道上有3个未成对电子,则N的价电子排布为4s24p3,N为砷元素。
(1)五种元素中,Be是唯一的一种金属,所以第一电离能最小的是Be。电负性最大的是O元素。
(2)Be元素原子的价层电子的电子排布图为![]() ,该元素的名称是铍。气态分子BeCl2的中心原子是铍,铍原子采用sp杂化轨道与2个氯原子成键,所以其立体构型为直线形。BeCl2分子中,铍原子核外有空轨道,氯原子有孤电子对,因此,BeCl2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键。
,该元素的名称是铍。气态分子BeCl2的中心原子是铍,铍原子采用sp杂化轨道与2个氯原子成键,所以其立体构型为直线形。BeCl2分子中,铍原子核外有空轨道,氯原子有孤电子对,因此,BeCl2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键。
(3)由O和As形成分子W的结构示意图以及两种元素的常见化合价(O的常见化合价为-2,As位于第VA族,故其常见化合价为-3、+3、+5)可知,化合物W的分子式为As4O6。在As4O6分子中,每个O原子有两个孤电子对、形成2个σ键,每个As原子有一个孤电子对、形成3外σ键,所以O、As的价层电子对数都是4,因此,O、As原子的杂化类型分别为sp3、sp3。
(4)已知化合物AsH3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成As4O6,此反应是检验微量AsH3的方法,该反应的化学方程式是4AsH3+24AgNO3+6H2O===As4O6+24Ag↓+24HNO3。
(5)配离子BeO4H![]() 就是Be(OH)42-,其中有2个配位键,配位原子为O原子,结构式为
就是Be(OH)42-,其中有2个配位键,配位原子为O原子,结构式为 ,1 mol该离子中含有的共价键数目为8NA。
,1 mol该离子中含有的共价键数目为8NA。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B. 用铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D. 用FeCl3溶液腐蚀印刷电路板上铜箱:2Fe3++Cu=2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为:MnO2+4HC1(浓) ![]() MnCl2+Cl2+2H2O,下列有关该反应的说法正确的是( )
MnCl2+Cl2+2H2O,下列有关该反应的说法正确的是( )
A.MnO2是还原剂
B.HCl被氧化
C.MnO2发生氧化反应
D.4molHCl参加反应则转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)装置甲中连通管a的作用是______________________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为______________________。
(4)装置丙中导管口水封的目的是______________________。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是________(填字母)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是______________________。
(7)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于Ⅲ区域的是( )
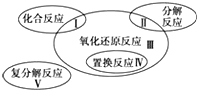
A. Cl2+2KBr=Br2+2KCl B. 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C. 2Na2O2+2CO2=2Na2CO3+O2 D. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室中进行化学实验,按下图甲连接好线路发现灯泡不亮,按下图乙连接好线路发现灯泡亮,下列结论一定正确的是
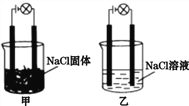
A. NaCl固体是非电解质而NaCl溶液是电解质
B. 在通电的条件下,NaCl在水中电离出大量的离子而导电
C. 甲的NaCl固体中无自由移动的阴阳离子,因此不能导电
D. 相同条件下,向乙的NaCl溶液中逐滴滴加硝酸银溶液,溶液导电性先减弱后增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( ) 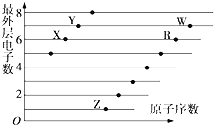
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:X>Y
D.X,Z形成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图表示正确的是

A. A图表示Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=+26.7kJ/mol反应的能量变化
B. B图表示碳的燃烧热
C. C图表示实验的环境温度20℃,将物质的量浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=60mL)
D. D图己知稳定性顺序:B![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com