
 2C(g)若经 2 s 后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s 后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:| A.①③ | B.②③ | C.①④ | D.③④ |
科目:高中化学 来源:不详 题型:单选题
| A.加热一般能加快化学反应速率 |
| B.粉碎固体物质能加快化学反应速率 |
| C.不同物质的化学反应速率可能不一样 |
| D.化学方程式中各物质的化学反应速率之比等于其质量比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为: (g)
(g)  2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题: 2NH3(g),下列哪种情况下,
2NH3(g),下列哪种情况下,| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入NH3的物质的量 |
| y | NH3的物质的量 | 平衡常数K | NH3的转化率 | 生成物物质的量总和 |
| | 0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | --------- |
| 实验2 | 5 | 5 | 40 | 25 | ---------- |
| 实验3 | 5 | 5 | V2 | 0 | ----------- |
 H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率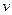 与时间t的关系如右图。
与时间t的关系如右图。 ;
;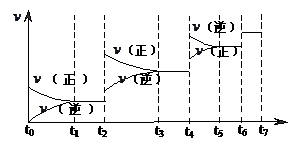
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.VA=3.0mol·L-1·min-1 | B.VB=0.28mol·L-1·S-1 |
| C.VC=4.8mol·L-1·min-1 | D.VD=1.0mol·L-1·S-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.容器乙的气体密度不再变化 | B.氢元素的质量不再变化 |
| C.氮气的生成速率等于氨气的消耗速率 | D.断裂1 mol N≡N键同时断裂6 mol N—H键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率 (表示反应物的消耗速率或生成物的生成速率)为( )
(表示反应物的消耗速率或生成物的生成速率)为( ) A. = 0.01 mol / (L·s) = 0.01 mol / (L·s) | B. = 0.008 mol / (L·s) = 0.008 mol / (L·s) |
C. = 0.003 mol / (L·s) = 0.003 mol / (L·s) | D. = 0.004 mol / (L·s) = 0.004 mol / (L·s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com