
| A. | KAl(SO4)2•12H2O不属于配合物 | |
| B. | 配位化合物中的配体可以是分子也可以是阴离子 | |
| C. | 配位数为4的配合物均为正四面体结构 | |
| D. | 已知[Cu(NH3)2]2+的空间构型为直线型,则它的中心原子采用sp杂化 |
分析 A.配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配合物中中心原子提供空轨道,配体提供孤电子对;
B.配位体(简称配体)可以为分子或离子;
C.配位数为4的配合物可以为正四面体结构,也可以为平面四边形结构,据此判断;
D.[Cu(NH3)2]2+中心原子的配位数是2,中心原子采用sp杂化,是直线型结构.
解答 解:A.KAl(SO4)2•12H2O属于一般化合物,不含配体,所以KAl(SO4)2•12H2O不属于配合物,故A正确;
B.[Ag(NH3)2]OH银离子提供空轨道、NH3中氮原子提供孤电子对而形成配位键,氨气分子为配体,Na[Al(OH)4]中铝原子提供空轨道,氢氧根离子提供孤电子对,氢氧根离子为配体,故B正确;
C.配位数为4的配合物可能为平面结构,[Cu(NH3)4]2+为平面正方形结构,故C错误;
D.在[Cu(NH3)2]2+中铜离子的配体是两个氨分子,原子的配位数是2,中心原子采用sp杂化,它们的空间构型为直线型,故D正确;
故选C.
点评 本题考查配合物的成键情况,注意配体、中心离子、外界离子的判断,把握相关概念,明确“只有有提供空轨道原子和提供孤电子对的原子”才能形成配位键,D选项[Cu(NH3)2]2+中心原子的配位数是2,中心原子采用sp杂化,是直线型结构,是高频考点,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 不慎将浓硫酸溅到皮肤上,应先用布拭去再用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
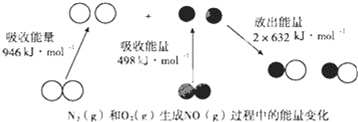
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑥⑧⑨ | B. | ①②⑤⑧ | C. | ①③④⑨ | D. | ②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
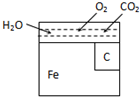 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com