
| A. | ②③④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①⑤⑦ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②金属晶体中原子半径越小,金属阳离子的电荷越多,金属单质的熔点越高;
③H没有中子,D含有1个中子;
④副族与第VIII族元素全部为金属元素;
⑤多电子原子中,在离核较近的区域内运动的电子能量较低;
⑥电子数相同的阳离子,原子序数越大,阳离子半径越小;
⑦两个非金属原子间以共用电子对成键,金属元素和非金属元素的原子间可能形成共价键.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故①错误;
②金属晶体中原子半径越小,金属阳离子的电荷越多,金属单质的熔点越高,原子半径:Al<Na<K,所以熔点:Al>Na>K,故②正确;
③H没有中子,D含有1个中子,所以NH3D+ 中质子数,电子数,中子数分别为 11,10,8,故③正确;
④元素周期表中从ⅢB族到ⅡB族10个纵行,包含副族与第VIII族元素,全部为金属元素,故④正确;
⑤多电子原子中,在离核较近的区域内运动的电子能量较低,离核较远的区域内运动的电子能量较高,故⑤错误;
⑥电子数相同的阳离子,原子序数越大,阳离子半径越小,所以第三周期元素原子形成的简单阳离子中,Al3+的半径最小,故⑥正确;
⑦两个非金属原子间以共用电子对成键,则两个非金属元素原子间只可能形成共价键,金属元素和非金属元素的原子间可能形成共价键,如氯化铝,故⑦错误.
故选A.
点评 本题考查元素周期律、化学键等,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
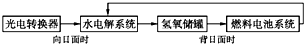 如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )| A. | 该能量转化系统工作时,需不断补充H2O | |
| B. | 该转化系统的能量本质上来源于太阳能 | |
| C. | 水电解系统中的阴极反应:O2+2H2O+4e-═4OH- | |
| D. | 燃料电池放电时的负极反应:H2-2e-═2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与其他元素生成的化合物都是离子化合物 | |
| D. | a.b.c.d与氢形成的化合物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| D. | 两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2•12H2O不属于配合物 | |
| B. | 配位化合物中的配体可以是分子也可以是阴离子 | |
| C. | 配位数为4的配合物均为正四面体结构 | |
| D. | 已知[Cu(NH3)2]2+的空间构型为直线型,则它的中心原子采用sp杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com