
| A. | 氮气的电子式  | B. | S2-的结构示意图: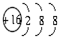 | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: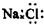 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑥⑧⑨ | B. | ①②⑤⑧ | C. | ①③④⑨ | D. | ②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
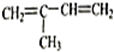 、⑨
、⑨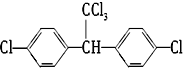 、⑩
、⑩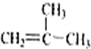
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
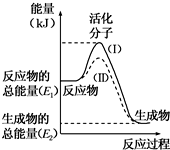 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
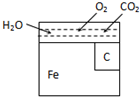 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 | |
| B. | 12 g C所具有的能量一定大于28 g CO所具有的能量 | |
| C. | △H1+△H2=△H3 | |
| D. | 将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化 学 键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量 (kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800 kJ | B. | 放出热量1520 kJ | C. | 吸收热量110 kJ | D. | 放出热量610 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com