
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
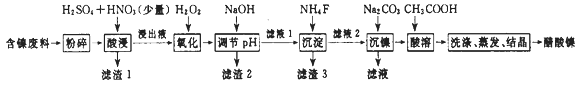
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.0×10-5 |
(1)将含镍废料粉碎的目的是_______________________________________________。
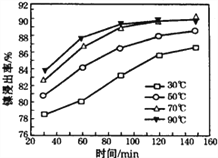
(2)“酸浸”实验中,镍的浸出率结果如图所示,从能量损耗和成本角度考虑,若要使镍的浸出效果最佳,选择的最好温度和时间分别为______℃、______ min。
(3)实验过程中,滤渣1主要成分的化学式为________、________。
(4)调节pH步骤中,溶液pH的调节范围是_____~______。选择此范围的目的是__________________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:______________________________。
(6)沉镍过程中,若c(Ni2+)=4.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为_____g。(保留小数点后1位有效数字)
【答案】 增大固液接触面积,提高镍的浸出率 70 120 SiO2 CaSO4 5.0 6.7 使Al3+、Fe3+转化为沉淀,二不能使Ni2+转化为沉淀 NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O 53.0
【解析】含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体;(1)将含镍废料粉碎的目的是增大固液接触面积,提高镍的浸出率;(2)由图象可知,为70℃、120min时,酸浸出率最高;(3)由流程分析可知,滤渣1为SiO2和CaSO4;(4)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为5.0≤pH<6.7;(5)酸浸过程中,1mol NiS被硝酸氧化失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2,其反应的化学方程式为:NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O;(5)已知NiCO3的Ksp=9.6×10-4,使100mL该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5molL-1],则溶液中c(CO32-)=![]() =
=![]() mol/L=1mol/L,与Ni2+反应的n(CO32-)=cV=4.0mol/L×0.1L=0.4mol,则加入的碳酸钠的总物质的量n(CO32-)=0.4mol+1mol/L×0.1L=0.5mol,所以m=nM=0.5mol×106g/mol=5.3g。
mol/L=1mol/L,与Ni2+反应的n(CO32-)=cV=4.0mol/L×0.1L=0.4mol,则加入的碳酸钠的总物质的量n(CO32-)=0.4mol+1mol/L×0.1L=0.5mol,所以m=nM=0.5mol×106g/mol=5.3g。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】用质量、形状均相同的锌片与下列条件下的稀硫酸反应时,化学反应速率最快的是( )
A.20℃1mol/L稀硫酸B.30℃1mol/L稀硫酸
C.20℃2mol/L稀硫酸D.30℃2mol/L稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是

A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性:X>Z
C. 非金属性:Y>Z
D. 最高价氧化物对应水化物的酸性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )

A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是 Fe-2e-===Fe2+
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和锌在工业中有重要作用。回答下列问题:
(1)已知氢氧化铜能溶于氨水形成[Cu(NH3)4]2+,则1mol[Cu(NH3)4]2+中含有______个σ键。
(2)CuO和Cu2O都能溶于盐酸,且Cu2O易发生歧化反应,写出Cu2O与盐酸反应的离子方程式________。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”),原因是_______________________。
(4)ZnF2具有较高的熔点(872℃),而ZnCl2、ZnBr2、ZnI2熔点都比较低,原因是________________。
(5)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为_____________,C原子的杂化形式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在500℃时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是( )

A. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
B. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
C. 取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com