
【题目】提出元素周期律并绘制了第一个元素周期表的科学家是( )
A.盖斯
B.阿伏伽德罗
C.门捷列夫
D.道尔顿
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 丙烷的二氯取代物有3种
B. ![]() 和苯乙烯互为同系物
和苯乙烯互为同系物
C. 饱和(NH4)2SO4溶液和福尔马林均可使蛋白质溶液产生沉淀,其原理相同
D. 聚合物(![]() )可由单体CH3CH=CH2和CH2=CH2加聚制得
)可由单体CH3CH=CH2和CH2=CH2加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
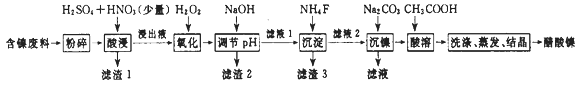
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.0×10-5 |
(1)将含镍废料粉碎的目的是_______________________________________________。
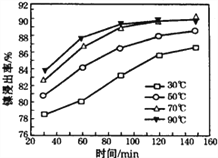
(2)“酸浸”实验中,镍的浸出率结果如图所示,从能量损耗和成本角度考虑,若要使镍的浸出效果最佳,选择的最好温度和时间分别为______℃、______ min。
(3)实验过程中,滤渣1主要成分的化学式为________、________。
(4)调节pH步骤中,溶液pH的调节范围是_____~______。选择此范围的目的是__________________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:______________________________。
(6)沉镍过程中,若c(Ni2+)=4.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为_____g。(保留小数点后1位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子轨道表示式为_______。
(2)AlH4-的空间构型为_______________,中心原子Al的轨道杂化方式为________;
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为________________(标明配位键)。
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于____晶体,其电子式为_____________。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____个;NaAlH4晶体的密度为________g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为__________(填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液中的c(OH-)=0.01 mol/L,则原溶液的浓度为( )
A.0.01 mol/LB.0.017 mol/LC.0.05 mol/LD.0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键与化合物的叙述中,不正确的是
A.离子化合物中一定含有金属离子B.共价化合物一定不含离子键
C.氯化钙含有离子键,不含共价键D.离子化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS![]() Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
A. 硫钠电池放电时负极反应为:Na-e-=Na+
B. 硫钠电池充电时,每生成1molNa转移xmol电子
C. 铂电极b为电解池阴极,电极反应式为N2+6e-+6H+=2NH3
D. 合成氨过程中H+经质子交换膜由a极向b极迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com