
����Ŀ���⻯���ƣ�NaAlH4����һ���������ʴ�����ϣ���������Ti��NaAlH4��150��ʱ���⣬��170�桢15.2MPa���������ظ����⡣NaAlH4����AlCl3��NaH���ʵ������ºϳɡ�NaAlH4�ľ����ṹ��ͼ��ʾ��

��1����̬Tiԭ�ӵ��۵��ӹ����ʾʽΪ_______��
��2��AlH4-�Ŀռ乹��Ϊ_______________������ԭ��Al�Ĺ���ӻ���ʽΪ________��
��3��AlCl3��178��ʱ����������������Է�������ԼΪ267���������ӵ��ṹʽΪ________________��������λ������
��4��NaH���۵�Ϊ800�棬�������л��ܼ�NaH����____���壬�����ʽΪ_____________��
��5��NaAlH4�����У���Na+�����ҵȾ��AlH4-��_____����NaAlH4������ܶ�Ϊ________g��cm-3���ú�a�Ĵ���ʽ��ʾ������NaAlH4�������Ĵ���Na+��Li+ȡ�����õ��ľ���Ϊ__________���ѧʽ����
��6��NaAlH4���������Ϊ��ÿ3��AlH4-�У���2���ֱ��ͷų�3��Hԭ�Ӻ�1��Alԭ�ӣ�ͬʱ���Alԭ������ڵ�Naԭ��ת�Ƶ����ͷŵ�Alԭ�����µĿ�λ���γ��µĽṹ�����ֽṹ�仯�ɱ������չ���������壬�Ӷ��ͷų���������������̿��û�ѧ����ʽ��ʾΪ____________________________________________��
���𰸡� ![]() ���������� sp3
���������� sp3 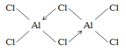 ����
���� ![]() 8
8 ![]() Na3Li(AlH4)4 3NaAlH4=Na3AlH6+2Al+3H2��
Na3Li(AlH4)4 3NaAlH4=Na3AlH6+2Al+3H2��
����������1��Tiԭ�Ӻ��������Ϊ22���۵����Ų�ʽΪ3d24s2���۵����Ų�ͼΪ![]() ����2��AlH4-��Al�Ĺ���ӻ���ĿΪ4+
����2��AlH4-��Al�Ĺ���ӻ���ĿΪ4+![]() =4��Al��ȡsp3�ӻ���Ϊ�������幹�ͣ���3���Ȼ�����178��ʱ�������۷е�ϵͣ����ڷ��Ӿ��壬��������Է�������ԼΪ267���������ӵķ���ʽΪAl2Cl6����ԭ����������ֻ��3�����ӣ��γ�3�����ۼ���ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ���������һ�����õ��Ӷ�����ԭ���ṩ�γɵ���λ�����ṹʽ��ͼ
=4��Al��ȡsp3�ӻ���Ϊ�������幹�ͣ���3���Ȼ�����178��ʱ�������۷е�ϵͣ����ڷ��Ӿ��壬��������Է�������ԼΪ267���������ӵķ���ʽΪAl2Cl6����ԭ����������ֻ��3�����ӣ��γ�3�����ۼ���ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ���������һ�����õ��Ӷ�����ԭ���ṩ�γɵ���λ�����ṹʽ��ͼ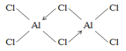 ����4��NaH���۵�Ϊ800�棬�������л��ܼ���Ӧ�������Ӿ��壬�����������⸺���ӹ��ɣ�����ʽΪ
����4��NaH���۵�Ϊ800�棬�������л��ܼ���Ӧ�������Ӿ��壬�����������⸺���ӹ��ɣ�����ʽΪ![]() ����5�����ݾ�̯����֪��������AlH4-��ĿΪ1+8��
����5�����ݾ�̯����֪��������AlH4-��ĿΪ1+8��![]() +4��
+4��![]() =4��Na+��ĿΪ6��
=4��Na+��ĿΪ6��![]() +4��
+4��![]() =4���������λ��Ϊ1��1�������ĵ�AlH4-�о�����֮�����ҵȾ��Na+λ�ھ�����֮�䡢�������������������Ҳ������ġ�����������������ǰ��������ģ���AlH4-�����ҵȾ��Na+��8��������Na+�����ҵȾ��AlH4-��8������������Ϊ4��
=4���������λ��Ϊ1��1�������ĵ�AlH4-�о�����֮�����ҵȾ��Na+λ�ھ�����֮�䡢�������������������Ҳ������ġ�����������������ǰ��������ģ���AlH4-�����ҵȾ��Na+��8��������Na+�����ҵȾ��AlH4-��8������������Ϊ4��![]() g�������ܶ�Ϊ
g�������ܶ�Ϊ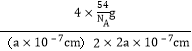 =
=![]() gcm-3����NaAlH4�������Ĵ���Na+��Li+ȡ������֪������Li+Ϊ1��Na+��ĿΪ3����������AlH4-��Ŀ���䣬�ɵû�ѧʽNa3Li[AlH4]4����6��NaAlH4���������Ϊ��ÿ3��AlH4-�У���2���ֱ��ͷų�3��Hԭ�Ӻ�1��Alԭ�ӣ�ͬʱ���Alԭ������ڵ�Naԭ��ת�Ƶ����ͷŵ�Alԭ�����µĿ�λ������ԭ���غ��֪��3NaAlH4��Na3AlH6+2Al+3H2������Ӧ����ʽΪ��3NaAlH4=Na3AlH6+2Al+3H2����
gcm-3����NaAlH4�������Ĵ���Na+��Li+ȡ������֪������Li+Ϊ1��Na+��ĿΪ3����������AlH4-��Ŀ���䣬�ɵû�ѧʽNa3Li[AlH4]4����6��NaAlH4���������Ϊ��ÿ3��AlH4-�У���2���ֱ��ͷų�3��Hԭ�Ӻ�1��Alԭ�ӣ�ͬʱ���Alԭ������ڵ�Naԭ��ת�Ƶ����ͷŵ�Alԭ�����µĿ�λ������ԭ���غ��֪��3NaAlH4��Na3AlH6+2Al+3H2������Ӧ����ʽΪ��3NaAlH4=Na3AlH6+2Al+3H2����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����˲ⶨ����Ħ�������̽��ʵ�飬��������طֽ���O2��
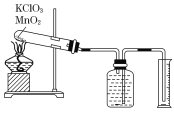
ʵ�鲽�����£�
�ٰ�����������ط�ĩ�������������̷�ĩ��Ͼ��ȣ����������Թ��У�ȷ�����Թܺ�ҩƷ��������Ϊ15.95 g��
�����Ӻ�ʵ��װ�ã����װ�õ������ԡ�
�ۼ��ȣ���ʼ��Ӧ��ֱ���������������Ϊֹ��
�ܲ���������Ͳ��ˮ�����Ϊ285.0 mL������ɱ�״�������������Ϊ279.7 mL.
��ȷ�����ԹܺͲ����������Ϊ15.55 g��
��������ʵ����̣��ش��������⣺
(1)��μ��װ�õ������ԣ�____________________________________________________________________________��
(2)�Թ��з����Ļ�ѧ��Ӧ����ʽΪ��_______________________________________��
(3)�����Dz����ռ������������������ļ������裺
�ٵ�����Ͳ�ĸ߶�ʹ���ƿ����Ͳ�ڵ�Һ��߶���ͬ
��ʹ�Թܺ��ƿ�����嶼��ȴ������
�۶�ȡ��Ͳ��Һ������
��������������ȷ˳����___________������д������룩��
���Т۵�ʵ�����ʱ�������Ӷ��������ȡ���������________������ƫ��������ƫС��������Ӱ��������
(4)ʵ������в������������ʵ�����________mol��ʵ����������Ħ�������________������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������д��ڵ���ƽ�⣺H2S![]() H++HS-��HS-
H++HS-��HS-![]() H++S2-����֪��ʽ��NaHS��Һ�ʼ��ԣ�����10mlŨ��Ϊ0.1mol/L���������м����������ʣ������ж���ȷ����
H++S2-����֪��ʽ��NaHS��Һ�ʼ��ԣ�����10mlŨ��Ϊ0.1mol/L���������м����������ʣ������ж���ȷ����
A. ��ˮ����ʹƽ�������ƶ�����Һ��������Ũ������
B. ����20mlŨ��Ϊ0.1mol/L NaOH��Һ����c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. ͨ�����SO2���壬ƽ�������ƶ�����ҺpHֵʼ������
D. ����10mlŨ��Ϊ0.1mol/L NaOH��Һ����c(Na+)>c(HS-)>c(OH��)>c(H+)>c(S2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ؿ��γɶ��ֻ�����ڹ�ҵ�����о�����Ҫ��ֵ�� ��ش��������⣺
��1����֪��1mol H��H ����1mol N��H���� 1mol N��N���ֱ���Ҫ��������436 kJ��391 kJ��946 kJ���Ҹ÷�ӦΪ���淴Ӧ����N2��H2��Ӧ�ϳ�NH3���Ȼ�ѧ����ʽΪ_________��
��2��һ���¶��£���һ������N2��H2����̶�������ܱ������н��кϳɰ���Ӧ��
������������˵���ÿ��淴Ӧ�ﵽ��ѧƽ��״̬����___________
A.������������ܶȲ��� B.c(N2)��c(H2)��c(NH3)=1��3��2
C.�����ڵ�ѹǿ���� D.3v��(H2) =2v��(NH3)
E. �����������ƽ����Է�����������
F. ��ͬʱ������3molH-H�����ѣ���6mol N-H���γ�
�ں��º�ѹ�����£�Ϊ��ߺϳɰ���Ӧ��N2��H2�������ʣ����Բ��õķ�����________________��
��3��һ���¶��£�2L�ܱ������г���0.40 mol N2O4��������Ӧ��N2O4(g)![]() 2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
2NO2(g)��һ��ʱ���ﵽƽ�⣬����������£�
ʱ�䣯s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
��20s�ڣ�v(NO2)=___________�����¶��·�Ӧ�Ļ�ѧƽ�ⳣ����ֵΪ_________��
�������¶�ʱ��������ɫ���������Ӧ��_________(��������������������)��Ӧ��
����ͬ�¶��£�����ʼ��������г���0.40 mol NO2����ﵽƽ���: c(NO2)_____0.15 mol��L-1(����>���� ��=������<��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ԫ�������ɲ������˵�һ��Ԫ�����ڱ��Ŀ�ѧ���ǣ� ��
A.��˹
B.����٤����
C.�Ž��з�
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����һ��Ԫ�أ�

�Իش��������⣺
��1������Ԫ���У�����d��Ԫ�ص���________����Ԫ�ط��ţ���h�����ڱ���λ����_________��
��2����e��f��ԭ�Ӹ���1��1�γɵľ����У���ѧ������Ϊ______________��
��3��Ԫ��k�Ļ�̬ԭ�ӵ����Ų�ʽΪ__________������c�ĺ�������Ų�ͼ��_____________��
��4��Ԫ��c�ĵ縺��______Ԫ��g�ĵ縺�ԣ����������=��������������Ԫ��b��c��e�ĵ�һ�������ɴ�С��˳����___________________����Ԫ�ط��ű�ʾ����
��5����ҵ��ұ��gԪ�صĵ��ʵĻ�ѧ����ʽ_______________________________��f�� h����Ԫ������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������Һ�д����������
A.HCO3�D��Na����OH�D��K��B.CO32�D��Ba2����K����NO3�D
C.Ba2����OH�D��Cl�D��Na��D.CO32�D��Na����NO3�D��H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ϵͳ�У���ʼ�¶�Ϊ25�棬��20.00mL0.1000mol/L�İ�ˮ����μ���0.1000mol/L��HC1��Һ����û����Һ���¶ȱ仯��ͼ��ʾ���������˵����ȷ����
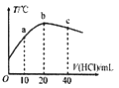
A. ��֪:25��ʱ��0.1000mol/L��ˮ�ĵ����Ϊ1.33%���ð�ˮ��pHԼΪ12
B. ��a����Һ�ʼ��ԣ���a����Һ��:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b����ҺpH=7��c����ҺpH<7
D. b����Һ��: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л���������ʱȽϣ���ȷ���ǣ� ��
A.���ԣ�HClO��HBrO4��HIO4
B.���ԣ�Al��OH��3��Mg��OH��2��NaOH
C.�ȶ��ԣ�PH3��H2S��HCl
D.�ǽ����ԣ�F��O��S
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com