
【题目】下列各组离子能在溶液中大量共存的是
A.HCO3―、Na+、OH―、K+B.CO32―、Ba2+、K+、NO3―
C.Ba2+、OH―、Cl―、Na+D.CO32―、Na+、NO3―、H+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子轨道表示式为_______。
(2)AlH4-的空间构型为_______________,中心原子Al的轨道杂化方式为________;
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为________________(标明配位键)。
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于____晶体,其电子式为_____________。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____个;NaAlH4晶体的密度为________g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为__________(填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液中的c(OH-)=0.01 mol/L,则原溶液的浓度为( )
A.0.01 mol/LB.0.017 mol/LC.0.05 mol/LD.0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键与化合物的叙述中,不正确的是
A.离子化合物中一定含有金属离子B.共价化合物一定不含离子键
C.氯化钙含有离子键,不含共价键D.离子化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从一种含银矿(含Ag、Zn、Cu、Pb及少量SiO2)中提取Ag、Cu及Pb的工艺流程如下:
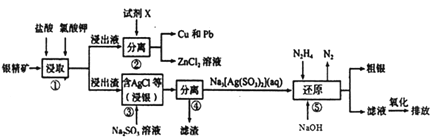
(1)步骤①提高矿物中金属离子浸取率,除可改变盐酸的浓度和氯酸钾的量外,还可采取的措施是__________(写出两种即可)
(2)步骤②中试剂X为______ (填化学式,下同);步骤④滤渣的成分为_______。
(3)步骤③发生反应的化学方程式为____________________。
(4)步骤⑤发生反应的离子方程式为____________________;其中N2H4(肼) 的电子式为____。
(5)“还原”后的“滤液”经氧化后,其中的溶质主要为_______。
(6) 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。若在AgC1的悬浊液中加入NaCl 固体,AgCl 沉淀的溶解度_____ (填“升高”、“不变”或“降低”),往AgCl 的悬浊液中滴加NaI溶液,当AgCl 开始转化为AgI时,I-的浓度必须不低于_____mol/L (不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
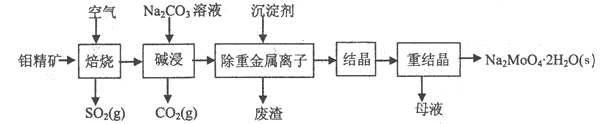
(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2![]() __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
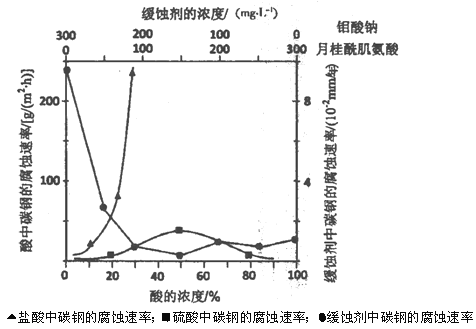
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com