
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
【答案】 +2 增加钛铁矿与硫酸按触面积,增大酸溶速率 2H++Fe==H2↑+Fe2+、Fe+2Fe3+==3Fe2+ 蒸发皿 TiO2++2H2O![]() TiO(OH)2+2H+ 促进水解( 或加快水解反应速率) 1.0×10-5 20:9
TiO(OH)2+2H+ 促进水解( 或加快水解反应速率) 1.0×10-5 20:9
【解析】钛铁矿[主要成分为钛酸亚铁(FeTiO)3,含有少量Fe2O3]加硫酸溶解生成TiO2+和Fe3+、Fe2+,加入铁还原铁离子:2Fe3++Fe=3Fe2+,得到硫酸亚铁和TiOSO4,对溶液蒸发浓缩、冷却结晶,过滤得到绿矾晶体和TiOSO4溶液,将TiOSO4溶液加热,促进TiO2+的水解生成TiO(OH)2,TiO2++2H2O=TiO(OH)2+2H+,分解得到钛白粉(TiO2);将绿矾与过氧化氢、H3PO4混合沉铁:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,将得到的FePO4与草酸、Li2CO3焙烧生成锂离子电池的正极材料LiFePO4。
(1)LiFePO4中Li的化合价为+1价,P为+5价O为-2价,根据正负化合价的代数和为0,Fe的化合价是+2,故答案为:+2;
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎可以增加钛铁矿与硫酸按触面积,增大酸溶速率,故答案为:增加钛铁矿与硫酸按触面积,增大酸溶速率;
(3)加入铁粉主要是还原铁离子,也会与过量的酸反应:2H++Fe==H2↑+Fe2+、2Fe3++Fe=3Fe2+;操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器为蒸发皿,故答案为:2H++Fe==H2↑+Fe2+、Fe+2Fe3+==3Fe2+;蒸发皿;
(4)TiO2+易水解生成TiO(OH)2,其水解的离子方程式为TiO2++2H2O![]() TiO(OH)2+2H+;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热可以促进水解,故答案为:TiO2++2H2O
TiO(OH)2+2H+;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热可以促进水解,故答案为:TiO2++2H2O![]() TiO(OH)2+2H+;促进水解;
TiO(OH)2+2H+;促进水解;
(5)Ksp(FePO4)= c(Fe3+) c(PO43-),则c(Fe3+)=![]() =
=![]() =1.0×10-5 mol/L,故答案为:1.0×10-5;
=1.0×10-5 mol/L,故答案为:1.0×10-5;
(6)“沉铁”的为绿矾与过氧化氢、H3PO4混合生成FePO4,离子方程式为:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,焙烧时的反应方程式为2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑;H2O2与草酸(H2C2O4)的物质的量之比为1:1,则17% H2O2溶液与草酸(H2C2O4)的质量比为
2LiFePO4+H2O+3CO2↑;H2O2与草酸(H2C2O4)的物质的量之比为1:1,则17% H2O2溶液与草酸(H2C2O4)的质量比为![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。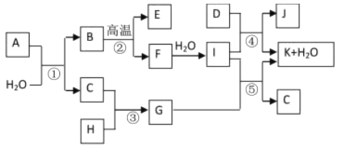
请回答下列问题:
(1)I中所含化学键类型_______________,
(2)G的水溶液呈酸性,用离子方程式表示其原因_______________________
(3)实验室制备气体C的化学方程式___________________________________________
(4)已知含7.4gI的稀溶液与200mL1mol/L的H溶液反应放出11.56kJ的热量,写出该反应的热化学方程式____________________________________________________
(5)物质A由三种元素组成,1 mol A与水反应可生成1 mol B和2 mol C,A化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是 ( )
A. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B. 已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g) ΔH2;则ΔH2>ΔH1
C. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D. 放热过程(ΔH<0)或熵增加(ΔS> 0)的过程一定是自发的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
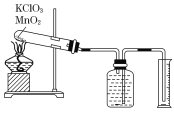
实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置,检查装置的气密性。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL.
⑤准确称量试管和残留物的质量为15.55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________________________________________。
(2)试管中发生的化学反应方程式为:_______________________________________。
(3)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是___________(请填写步骤代码)。
进行③的实验操作时,若仰视读数,则读取氧气的体积________(填“偏大”、“偏小”或“无影响”)。
(4)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氨气的还原性,某同学设计了下列实验装置( 其中夹持装置略去),在实验室中进行实验探究。回答下列问题:
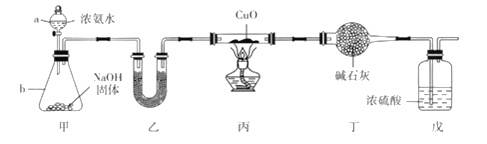
(1)仪器b的名称是_____________________,试解释该装置中产生NH3的原理:____________。
(2)装置乙中盛有的试剂名称是__________________。
(3)装置戊中浓硫酸的作用是_______________________________________________。
(4)+1价Cu 在酸性环境中不稳定,可发生反应:Cu2O+2H+==Cu2++Cu + H2O。某同学取上述反应后玻璃管内的物质于试管中,加入稀硫酸,振荡后发现溶液为蓝色,且试管底部有红色Cu,他得出结论:NH3还原CuO生成Cu2O。该同学的判断是否正确?________(填“正确”或“不正确”),理由是__________________________________________________________________。
(5)已知装置丙的玻璃管内CuO粉末为mg,实验结束后测得玻璃管内固体粉末为n g,若CuO 完全被还原 为 Cu,则 m:n=______;写出玻璃管内发生反应的化学方程式:__________________。装置丁中的干燥管增重为_______g(用含m 或n 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A.HCO3―、Na+、OH―、K+B.CO32―、Ba2+、K+、NO3―
C.Ba2+、OH―、Cl―、Na+D.CO32―、Na+、NO3―、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com