
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。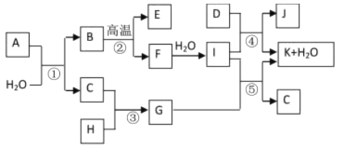
请回答下列问题:
(1)I中所含化学键类型_______________,
(2)G的水溶液呈酸性,用离子方程式表示其原因_______________________
(3)实验室制备气体C的化学方程式___________________________________________
(4)已知含7.4gI的稀溶液与200mL1mol/L的H溶液反应放出11.56kJ的热量,写出该反应的热化学方程式____________________________________________________
(5)物质A由三种元素组成,1 mol A与水反应可生成1 mol B和2 mol C,A化学式为_______________。
【答案】 离子键 共价键 NH4+ + H2O![]() NH3·H2O + H+ Ca(OH)2+2 NH4Cl
NH3·H2O + H+ Ca(OH)2+2 NH4Cl![]() CaCl2+2NH3↑+2H2O Ca(OH)2(aq)+2HCl(aq)=CaCl2(aq)+2H2O(l) △H=-115.6kJ/mol CaCN2
CaCl2+2NH3↑+2H2O Ca(OH)2(aq)+2HCl(aq)=CaCl2(aq)+2H2O(l) △H=-115.6kJ/mol CaCN2
【解析】题中各物质都是由1~20号元素中部分元素组成的单质或其化合物,结合已知和流程,D是一种黄绿色的气体单质,则D是Cl2;物质J可用于泳池消毒,则J是Ca(ClO)2,所以K是CaCl2、I是Ca(OH)2;F和水反应生成I,则F是CaO;B高温生成E和F,则E为CO2、B是CaCO3;C、H是无色有刺激性气味的气体,且反应生成G,G和I[Ca(OH)2]反应生成K(CaCl2)、H2O和C,则G中含有氯元素,所以G是NH4Cl、C是NH3、H是HCl。
(1)I是Ca(OH)2,钠离子与氢氧根离子之间是离子键,氢氧根离子中H与O之间是共价键,故所含化学键类型为:离子键和共价键。
(2)G是NH4Cl,属于强酸弱碱盐,NH4+水解使溶液显酸性,离子方程式为:NH4++H2O![]() NH3H2O+H+。
NH3H2O+H+。
(3)C是NH3,实验室常用Ca(OH)2和NH4Cl固体在加热条件下制取氨气,化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(4)I是Ca(OH)2,7.4gCa(OH)2的物质的量是:7.4g÷74gmol-1=0.1mol;H是HCl,200mL1mol/L的HCl溶液中溶质的物质的量是:0.2L×1mol/L=0.2mol,0.1molCa(OH)2与0.2molHCl恰好完全反应放出11.56kJ的热量,所以该反应的热化学方程式为:Ca(OH)2(aq)+2HCl(aq)=CaCl2(aq)+2H2O(l) △H=-115.6kJ/mol。
(5)已知物质A由三种元素组成,1molA与水反应可生成1molB和2molC,该反应可表示为:A+H2O→CaCO3+2NH3,则A中应含有Ca、C、N三种元素,根据O原子守恒可得H2O的化学计量数为3,所以A的化学式为CaCN2。


科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是
A. 用 100 mL 量筒量取 12.5 mL 盐酸
B. 称量 NaOH 固体时,将 NaOH 直接放在托盘上的纸上
C. 需用 220 mL, 1 mol·L-1 CuSO4 溶液,配制时需称 62.5g 的 CuSO4·5H2O 晶体
D. 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A.由已知信息可得:NA=![]() B.Wg该原子的物质的量一定是
B.Wg该原子的物质的量一定是 ![]() mol
mol
C.Wg该原子中含有![]() 个该原子g D.该原子的摩尔质量是aNA g
个该原子g D.该原子的摩尔质量是aNA g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________________mol。
(2)该气体所含原子总数为________________个。
(3)该气体在标准状况下的体积为_________________L。
(4)该气体在标准状况下的密度为_______________ g/L。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是
A. 氧化性:Cr2O72->Fe3+>SO2
B. K2Cr2O7能将Na2SO3氧化成Na2SO4
C. 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D. 若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的流程如下:
![]()
(1)写出②中除烧杯外还要用到的玻璃仪器的名称:_______。
(2)有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如下图蒸馏实验装置,此装置中的明显错误之处为____________ 、______________。

(3)实际操作时,利用蒸馏方法分离I2的CCl4溶液获
得I2的量大 大少于预期,试分析其主要原
因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
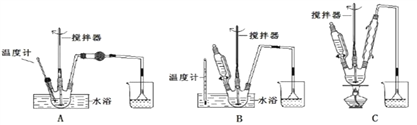
请回答下列问题:(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①Cu2+的价电子排布图________________; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②SO42-的空间构型为_____________,SO32-离子中心原子的杂化方式为__________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:___________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是________
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com