
����Ŀ��ͭ���������ճ������г����Ľ��������ǵĵ��ʼ��仯�����ڿ�ѧ�о���ũҵ�����о��й㷺��;��
��ش��������⣺
��1����ϸͭ�ۿ�����������ϡ������ȣ����Ʊ��������£�

��Cu2+�ļ۵����Ų�ͼ________________; NH4CuSO3��N��O��S����Ԫ�صĵ�һ�������ɴ�С˳��Ϊ_______________________(��Ԫ�ط���)��
��SO42-�Ŀռ乹��Ϊ_____________��SO32-��������ԭ�ӵ��ӻ���ʽΪ__________��
��2����д����Cu(NH3)4SO4ˮ��Һ��ͨ��SO2ʱ������Ӧ�����ӷ���ʽ��___________��
��3��ijѧ����CuSO4��Һ�м���������ˮ������ɫ�������������������ˮ�����ܽ⣬�õ�����ɫ����Һ����������Һ�м���һ�����Ҵ�������[Cu(NH3)4]SO4��H2O���塣
������˵����ȷ����________
a��������������ˮ������ΪNH3���Ӻ�H2O����֮���γ�3�ֲ�ͬ�����
b��NH3���Ӻ�H2O���ӣ����ӿռ乹�Ͳ�ͬ���������ӵļ���С��ˮ���ӵļ���
c��Cu(NH3)4SO4�����еĻ�ѧ�������Ӽ������Թ��ۼ�����λ��
d��Cu(NH3)4SO4���Ԫ���е縺�������ǵ�Ԫ��
������ͼ����Ҵ������������ԭ��_____________________��
���𰸡� 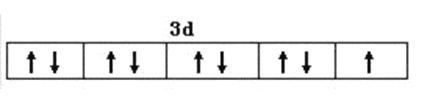 N>O>S ���������� sp3�ӻ� 2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3��+6NH4++SO42- c �Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ��
N>O>S ���������� sp3�ӻ� 2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3��+6NH4++SO42- c �Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ��
����������1����Cu��29��Ԫ�أ�Cu2+�ļ۲��������9��������Cu2+�۵����Ų�ͼ��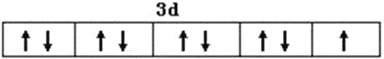 ��N��O��S����Ԫ��������Nԭ�ӵ�2p����ǰ����״̬�����Ե�һ���������ͬ����Ԫ�أ�����Ӳ��������࣬��һ��������С������3��Ԫ�صĵ�һ�������ɴ�С˳��Ϊ��N��O��S����SO42���ļ۲���Ӷ���=4+��6+2-4��2��/2=4�����Կռ乹��Ϊ���������ͣ�SO32�����ӵļ۲���Ӷ���=3+��6+2-3��2��/2=4����������ԭ�ӵ��ӻ���ʽΪsp3�ӻ�����2��������ͼ��֪��[Cu(NH3)4]SO4ˮ��Һ��ͨ��SO2ʱ���ɰ�ɫ�������������������Ļ�ѧʽ��д���ӷ���ʽΪ��2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3��+6NH4++SO42-����3����a��������������ˮ������ΪNH3���Ӻ�H2O����֮���γ�2�ֲ�ͬ�������N��H��O��H֮�䣬a����b��NH3���Ӻ�H2O���ӣ����ӿռ乹�Ͳ�ͬ�������������ͣ�ˮ�ǽ��Σ��������ӵļ��Ǵ���ˮ���ӵļ��ǣ�b����c��Cu(NH3)4SO4�����еĻ�ѧ�������Ӽ������Թ��ۼ�����λ���������������������֮�������Ӽ���N��H֮���ǹ��ۼ���������ͭ����֮������λ����c��ȷ��d��Cu(NH3)4SO4���Ԫ���е縺����������Ԫ�أ�d����ѡc���ڸ�����������ԭ�������Է��������ڼ����ܼ����Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�ȡ�
��N��O��S����Ԫ��������Nԭ�ӵ�2p����ǰ����״̬�����Ե�һ���������ͬ����Ԫ�أ�����Ӳ��������࣬��һ��������С������3��Ԫ�صĵ�һ�������ɴ�С˳��Ϊ��N��O��S����SO42���ļ۲���Ӷ���=4+��6+2-4��2��/2=4�����Կռ乹��Ϊ���������ͣ�SO32�����ӵļ۲���Ӷ���=3+��6+2-3��2��/2=4����������ԭ�ӵ��ӻ���ʽΪsp3�ӻ�����2��������ͼ��֪��[Cu(NH3)4]SO4ˮ��Һ��ͨ��SO2ʱ���ɰ�ɫ�������������������Ļ�ѧʽ��д���ӷ���ʽΪ��2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3��+6NH4++SO42-����3����a��������������ˮ������ΪNH3���Ӻ�H2O����֮���γ�2�ֲ�ͬ�������N��H��O��H֮�䣬a����b��NH3���Ӻ�H2O���ӣ����ӿռ乹�Ͳ�ͬ�������������ͣ�ˮ�ǽ��Σ��������ӵļ��Ǵ���ˮ���ӵļ��ǣ�b����c��Cu(NH3)4SO4�����еĻ�ѧ�������Ӽ������Թ��ۼ�����λ���������������������֮�������Ӽ���N��H֮���ǹ��ۼ���������ͭ����֮������λ����c��ȷ��d��Cu(NH3)4SO4���Ԫ���е縺����������Ԫ�أ�d����ѡc���ڸ�����������ԭ�������Է��������ڼ����ܼ����Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�ȡ�


 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ҫ�� NaOH �������� 80mL 1.00mol��L-1 �� NaOH ��Һ���Իش����и��⣺
��1�����dz������ƹ��̼���Ϊ���¸����裺
A����ȴ B������ C��ϴ�� D������ E���ܽ� F��ҡ�� G��ת����Һ ����ȷ�IJ���˳��Ӧ��_____________________(����������)��
��2���ڳ���ʱ����������ƽȷ����_____g ���� NaOH��
��3����ʵ������õ�����������ƽ��ҩ�ס��ձ���������������Ҫ��������_____��
��4�����ݵIJ���Ҫ���ǣ�__________��
��5�� ���ù����У����²�����ʹ NaOH ��Һ���ʵ���Ũ��ƫ�ߵ���_____��
A��ת����Һ��δϴ���ձ��Ͳ�������ֱ�Ӷ���
B������ʱ���ӿ̶���
C��������ƿת��ʱ�������� NaOH Һ�彦��
D������ƿδ���T����������Һ
E�����ݺ�����ƿ������ҡ�ȣ����ú�Һ�治���̶��ߣ��ټ�ˮ���̶���
F��������ƿ��ת����Һʱ��δ����Һ��ȴ�ͽ��ж���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����������1��20��Ԫ���в���Ԫ����ɵĵ��ʻ��仯���ͼ�в��ַ�Ӧ����δ�г�����֪C��H����ɫ�д̼�����ζ�����壬D��һ�ֻ���ɫ�����嵥�ʣ�����J������Ӿ����������Ӧ�ں͢��ǻ��������е���Ҫ��Ӧ����Ӧ����ʵ�����Ʊ�����C����Ҫ������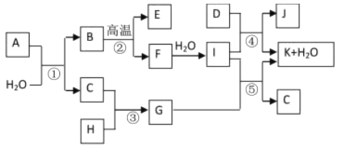
��ش��������⣺
��1��I��������ѧ������_______________��
��2��G��ˮ��Һ�����ԣ������ӷ���ʽ��ʾ��ԭ��_______________________
��3��ʵ�����Ʊ�����C�Ļ�ѧ����ʽ___________________________________________
��4����֪��7.4gI��ϡ��Һ��200mL1mol/L��H��Һ��Ӧ�ų�11.56kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ____________________________________________________
��5������A������Ԫ����ɣ�1 mol A��ˮ��Ӧ������1 mol B��2 mol C��A��ѧʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ���������У���ȷ����
A.���ӻ�������ܺ����ۼ�
B.���ۻ�������ܺ����Ӽ�
C.���ӻ�������ֻ�����Ӽ�
D.ֻ�л��ý�������÷ǽ���������γ����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A. 0.01mol/L NH4Al(SO4)2��Һ��0.02mol/L Ba(OH��2��Һ��������:NH4����Al3����2SO42����2Ba2����4OH����2BaSO4����Al(OH)3����NH3��H2O
B. FeCl2������Һ���ڿ����б��ʣ�2Fe2����4H����O2=2Fe3����2H2O
C. ��CH3COOH�ܽ�CaCO3��CaCO3��2H��=Ca2����H2O��CO2��
D. ���MgCl2ˮ��Һ�����ӷ���ʽ��2Cl����2H2O![]() H2����Cl2����2OH��
H2����Cl2����2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ȿ�������ɱ���������ֿ���Ư�������������õ������ǣ� ��
A.Cl2
B.HCl
C.HClO
D.H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���� �� ��
A. ��֪C(ʯī��s)��C(���ʯ��s) ��H��0������ʯ��ʯī�ȶ�
B. ��֪C(s)��O2(g)��CO2(g) ��H1 C(s)��1/2O2(g)��CO(g) ��H2������H2����H1
C. ��֪2H2(g)��O2(g)��2H2O(g) ��H����483.6 kJ/mol����������ȼ����Ϊ241.8 kJ/mol
D. ���ȹ���(��H��0)��������(��S�� 0)�Ĺ���һ�����Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����˲ⶨ����Ħ�������̽��ʵ�飬��������طֽ���O2��
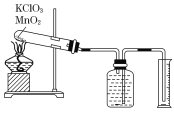
ʵ�鲽�����£�
�ٰ�����������ط�ĩ�������������̷�ĩ��Ͼ��ȣ����������Թ��У�ȷ�����Թܺ�ҩƷ��������Ϊ15.95 g��
�����Ӻ�ʵ��װ�ã����װ�õ������ԡ�
�ۼ��ȣ���ʼ��Ӧ��ֱ���������������Ϊֹ��
�ܲ���������Ͳ��ˮ�����Ϊ285.0 mL������ɱ�״�������������Ϊ279.7 mL.
��ȷ�����ԹܺͲ����������Ϊ15.55 g��
��������ʵ����̣��ش��������⣺
(1)��μ��װ�õ������ԣ�____________________________________________________________________________��
(2)�Թ��з����Ļ�ѧ��Ӧ����ʽΪ��_______________________________________��
(3)�����Dz����ռ������������������ļ������裺
�ٵ�����Ͳ�ĸ߶�ʹ���ƿ����Ͳ�ڵ�Һ��߶���ͬ
��ʹ�Թܺ��ƿ�����嶼��ȴ������
�۶�ȡ��Ͳ��Һ������
��������������ȷ˳����___________������д������룩��
���Т۵�ʵ�����ʱ�������Ӷ��������ȡ���������________������ƫ��������ƫС��������Ӱ��������
(4)ʵ������в������������ʵ�����________mol��ʵ����������Ħ�������________������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������д��ڵ���ƽ�⣺H2S![]() H++HS-��HS-
H++HS-��HS-![]() H++S2-����֪��ʽ��NaHS��Һ�ʼ��ԣ�����10mlŨ��Ϊ0.1mol/L���������м����������ʣ������ж���ȷ����
H++S2-����֪��ʽ��NaHS��Һ�ʼ��ԣ�����10mlŨ��Ϊ0.1mol/L���������м����������ʣ������ж���ȷ����
A. ��ˮ����ʹƽ�������ƶ�����Һ��������Ũ������
B. ����20mlŨ��Ϊ0.1mol/L NaOH��Һ����c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. ͨ�����SO2���壬ƽ�������ƶ�����ҺpHֵʼ������
D. ����10mlŨ��Ϊ0.1mol/L NaOH��Һ����c(Na+)>c(HS-)>c(OH��)>c(H+)>c(S2-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com