
【题目】下列变化中,不可能通过一步反应实现的是( )
A.SiO2—Na2SiO3B.SiO2—H2SiO3C.SiO2—SiD.Si—SiCl4
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1mol H-H 键,1mol N-H键, 1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,且该反应为可逆反应,则N2与H2反应合成NH3的热化学方程式为_________。
(2)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应,
①下列描述能说明该可逆反应达到化学平衡状态的有___________
A.容器内气体的密度不变 B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.容器内的压强不变 D.3v正(H2) =2v逆(NH3)
E. 容器内气体的平均相对分子质量不变
F. 相同时间内有3molH-H键断裂,有6mol N-H键形成
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可以采用的方法有________________。
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=___________,该温度下反应的化学平衡常数数值为_________。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40 mol NO2,则达到平衡后: c(NO2)_____0.15 mol·L-1(填“>”、 “=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,表中所列字母分别代表一种元素.

试回答下列问题:
(1)以上元素中,属于d区元素的是________(填元素符号),h在周期表的位置是_________。
(2)由e、f以原子个数1∶1形成的晶体中,化学键类型为______________。
(3)元素k的基态原子电子排布式为__________;画出c的核外电子排布图:_____________。
(4)元素c的电负性______元素g的电负性(填“>”、“=”、“<”),元素b、c、e的第一电离能由大到小的顺序是___________________(用元素符号表示)。
(5)工业上冶炼g元素的单质的化学方程式_______________________________,f、 h两种元素最高价氧化物对应的水化物反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A.HCO3―、Na+、OH―、K+B.CO32―、Ba2+、K+、NO3―
C.Ba2+、OH―、Cl―、Na+D.CO32―、Na+、NO3―、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水中逐滴加入0.1000mol/L的HC1溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是
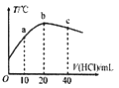
A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,该氨水的pH约为12
B. 若a点溶液呈碱性,则a点溶液中:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b点溶液pH=7,c点溶液pH<7
D. b点溶液中: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJmol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196kJmol-1
H2(g)+![]() O2(g)═H2O(l)△H=-285kJmol-1
O2(g)═H2O(l)△H=-285kJmol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________________
(2)①在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl(氯化亚铜)沉淀,同时溶液的酸性增强.制备CuCl的离子方程式是___________
②在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,![]() ________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
③若在0.15![]() 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量![]() 气体,使
气体,使![]() 完全沉淀为CuS,此时溶液中的
完全沉淀为CuS,此时溶液中的![]() 浓度是______
浓度是______![]()
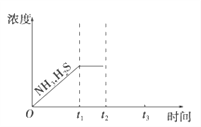
(3)工业上常用氨水吸收H2S进行废气脱硫,生成NH4HS。一定温度下1molNH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。下图1是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图1上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线_________________________。
(4)可利用H2S废气进行高温热分解制取氢气,实现化废为宝。
已知:![]()
在恒温密闭容器中,控制不同温度进行![]() 分解实验。以
分解实验。以![]() 起始浓度均为0.2
起始浓度均为0.2 ![]() 测定
测定![]() 的转化率,结果见下图。
的转化率,结果见下图。

图中a为![]() 的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时![]() 的转化率。据图计算985℃时
的转化率。据图计算985℃时![]() 按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com