
【题目】废弃物的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJmol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196kJmol-1
H2(g)+![]() O2(g)═H2O(l)△H=-285kJmol-1
O2(g)═H2O(l)△H=-285kJmol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________________
(2)①在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl(氯化亚铜)沉淀,同时溶液的酸性增强.制备CuCl的离子方程式是___________
②在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,![]() ________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
③若在0.15![]() 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量![]() 气体,使
气体,使![]() 完全沉淀为CuS,此时溶液中的
完全沉淀为CuS,此时溶液中的![]() 浓度是______
浓度是______![]()
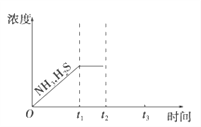
(3)工业上常用氨水吸收H2S进行废气脱硫,生成NH4HS。一定温度下1molNH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。下图1是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图1上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线_________________________。
(4)可利用H2S废气进行高温热分解制取氢气,实现化废为宝。
已知:![]()
在恒温密闭容器中,控制不同温度进行![]() 分解实验。以
分解实验。以![]() 起始浓度均为0.2
起始浓度均为0.2 ![]() 测定
测定![]() 的转化率,结果见下图。
的转化率,结果见下图。

图中a为![]() 的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时![]() 的转化率。据图计算985℃时
的转化率。据图计算985℃时![]() 按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
【答案】 Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1 2Cu2++SO32-+2Cl-+H2O==2CuCl↓+SO42-+2H+ 2.2×10-10 0.30 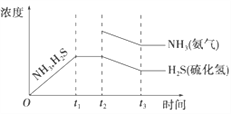 0.13 温度升高,反应速率加快,达到平衡所需的时间缩短
0.13 温度升高,反应速率加快,达到平衡所需的时间缩短
【解析】(1). 已知:① Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJmol-1、② 2H2O2(l)═2H2O(l)+O2(g)△H=-196kJmol-1、③ H2(g)+![]() O2(g)═H2O(l)△H=-285kJmol-1,根据盖斯定律,①+②÷2+③得:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1,故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1;
O2(g)═H2O(l)△H=-285kJmol-1,根据盖斯定律,①+②÷2+③得:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1,故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319kJmol-1;
(2). ①. 由题中信息可知,CuSO4中的Cu元素从+2价降低到+1价,Na2SO3中的S元素从+4价升高到+6价,根据得失电子守恒和原子守恒,该反应的离子方程式为:2Cu2++SO32-+2Cl-+H2O==2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O==2CuCl↓+SO42-+2H+;
②. 溶液pH=9, c(OH-)=10-5mol/L,当有氢氧化铜沉淀生成时,c(Cu2+)=![]() =
=![]() =2.2×10-10mol/L,故答案为:2.2×10-10;
=2.2×10-10mol/L,故答案为:2.2×10-10;
③. 在0.15mol/L硫酸铜溶液中通入过量H2S气体,使Cu2+完全转化为CuS沉淀,反应的化学方程式为:CuSO4+H2S=CuS↓+H2SO4,此时溶液中的溶质为硫酸,c(SO42-)不变,仍然为0.15mol/L,由硫酸的化学式可知,溶液中的c(H+)=0.3mol/L,故答案为:0.3;
(3). 若t2时增大氨气的浓度,氨气的浓度突然增大,在这一瞬间硫化氢的浓度不变,然后平衡逆向移动,氨气的浓度和硫化氢的浓度都减小,再次达到平衡时,氨的浓度比原平衡的浓度要高,且NH3与H2S浓度的降低比例是相同的,即图象中的斜率相同,则图象为: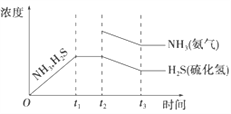 ,故答案为:
,故答案为: ;
;
(4). 以H2S起始浓度均为0.2molL1测定H2S的转化率,985℃时H2S的转化率为40%,则
H2S(g) H2(g) + ![]() S2(g),
S2(g),
起始浓度(mol/L) 0.2 0 0
转化浓度(mol/L) 0.08 0.08 0.04
平衡浓度(mol/L) 0.12 0.08 0.04
由反应方程式可知,该分解反应的平衡常数K=![]() =0.13,随着温度的升高,反应速率加快,达到平衡时需要的时间缩短,所以曲线b向曲线a逼近,故答案为:0.13;温度升高,反应速率加快,达到平衡所需的时间缩短。
=0.13,随着温度的升高,反应速率加快,达到平衡时需要的时间缩短,所以曲线b向曲线a逼近,故答案为:0.13;温度升高,反应速率加快,达到平衡所需的时间缩短。


科目:高中化学 来源: 题型:
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
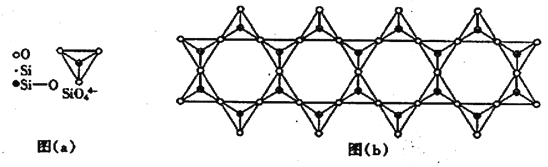
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
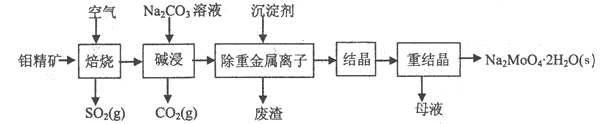
(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2![]() __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
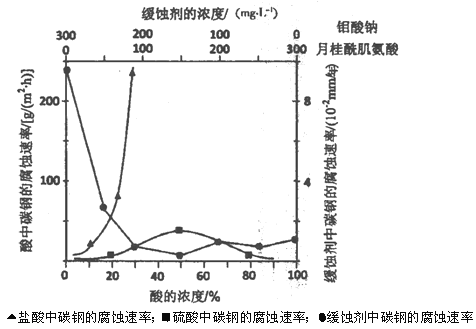
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4【UO2(CO3)3】等。回答下列问题:
(1) UF4用Mg或Ca还原可得金属铀。金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为__________________;基态钙原子核外电子排布式为_________________;熔点:MgO(2852℃)高于CaO(2614℃),其原因是_____________________________。
(2) ![]() 。NH4HF2中所含作用力有____________(填字母)。
。NH4HF2中所含作用力有____________(填字母)。
a. 氢键 b. 配位键 c. 共价键 d. 离子键 e. 金属键
(3)已知:![]() .
.
①NH4+ 的空间构型为__________________,与NH4+ 互为等电子体的分子或离子有________(写两种)
②CO32- 中碳原子杂化轨道类型为______________________。
③分解产物中属于非极性分子的是_____________________(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
(4) UO2 的晶胞结构及晶胞参数如下图所示:
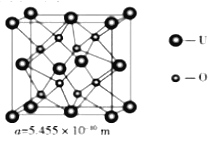
①晶胞中U的配位数为_________________。
②UO2 的密度为_________________g·cm-3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO |
|
|
电离平衡常数 |
|
|
|
|
(1)室温下![]()
![]()
![]()
![]()
![]() 溶液的pH由大到小的关系为______.
溶液的pH由大到小的关系为______.
(2)浓度均为![]() 的
的![]() 和
和![]() 的混合溶液中,
的混合溶液中, ![]() 、
、![]() 、
、![]() 、
、![]() 浓度从大到小的顺序为______.
浓度从大到小的顺序为______.
(3)少量![]() 通入到过量的NaClO溶液中发生反应的离子方程式______.
通入到过量的NaClO溶液中发生反应的离子方程式______.
(4)常温下, ![]() 的HCOOH溶液与
的HCOOH溶液与![]() 的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A是一种农药生产的中间体,A在一定条件下可发生如图转化:

请回答下列问题:
(1)![]() 分子中不含氧官能团的名称为 ______ .
分子中不含氧官能团的名称为 ______ .
(2)![]() 不能发生反应的类型有 ______
不能发生反应的类型有 ______ ![]() 填字母
填字母![]() .
.
![]() 取代反应
取代反应![]() 消去反应
消去反应![]() 加成反应
加成反应![]() 氧化反应
氧化反应
(3)反应![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
(4)写出B到C的离子方程式 ______ .
(5)![]() 在一定条件下反应能生成高分子化合物,写出此高分子化合物所有可能的结构简式: ______ .
在一定条件下反应能生成高分子化合物,写出此高分子化合物所有可能的结构简式: ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com