
【题目】
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4【UO2(CO3)3】等。回答下列问题:
(1) UF4用Mg或Ca还原可得金属铀。金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为__________________;基态钙原子核外电子排布式为_________________;熔点:MgO(2852℃)高于CaO(2614℃),其原因是_____________________________。
(2) ![]() 。NH4HF2中所含作用力有____________(填字母)。
。NH4HF2中所含作用力有____________(填字母)。
a. 氢键 b. 配位键 c. 共价键 d. 离子键 e. 金属键
(3)已知:![]() .
.
①NH4+ 的空间构型为__________________,与NH4+ 互为等电子体的分子或离子有________(写两种)
②CO32- 中碳原子杂化轨道类型为______________________。
③分解产物中属于非极性分子的是_____________________(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
(4) UO2 的晶胞结构及晶胞参数如下图所示:
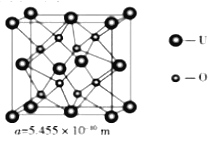
①晶胞中U的配位数为_________________。
②UO2 的密度为_________________g·cm-3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
【答案】 68% ![]() 或【Ar】4s2 CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高(答案合理即可) abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等 sp2 bc 8
或【Ar】4s2 CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高(答案合理即可) abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等 sp2 bc 8 ![]()
【解析】(1). 体心立方中含有U原子的个数为1+8×![]() =2,设U原子的半径为rcm,则晶胞中U原子的体积为:2×
=2,设U原子的半径为rcm,则晶胞中U原子的体积为:2×![]() ×π×r3,在体心立方中,体对角线上为三个U原子相切,则体对角线为4rcm,晶胞边长为
×π×r3,在体心立方中,体对角线上为三个U原子相切,则体对角线为4rcm,晶胞边长为![]() cm,晶胞体积为
cm,晶胞体积为![]() ,空间利用率为[(2×
,空间利用率为[(2×![]() ×π×r3)÷
×π×r3)÷![]() ]×100%=68%,钙是20号元素,基态钙原子核外电子排布式为1s22s22p63s23p64s2或[Ar]4s2,MgO和CaO都是离子晶体,镁离子的半径小于钙离子半径,MgO的晶格能大于CaO,所以MgO晶体的熔点高,故答案为:68%;1s22s22p63s23p64s2或[Ar]4s2;CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高;
]×100%=68%,钙是20号元素,基态钙原子核外电子排布式为1s22s22p63s23p64s2或[Ar]4s2,MgO和CaO都是离子晶体,镁离子的半径小于钙离子半径,MgO的晶格能大于CaO,所以MgO晶体的熔点高,故答案为:68%;1s22s22p63s23p64s2或[Ar]4s2;CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高;
(2). NH4HF2中含有NH4+、H+和F-,该化合物是离子化合物,所以含有离子键,N原子与H原子之间存在共价键、配位键和氢键,故答案为:abcd;
(3). ①. NH4+中N原子的价层电子对数=4+![]() =4+0=4,N原子的杂化方式为sp3,没有孤电子对,所以NH4+的空间构型是正四面体形,根据等电子体原理,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4等,故答案为:正四面体;CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等;
=4+0=4,N原子的杂化方式为sp3,没有孤电子对,所以NH4+的空间构型是正四面体形,根据等电子体原理,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4等,故答案为:正四面体;CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等;
②. CO32-中碳原子的价层电子对数=3+![]() =3,所以碳原子杂化轨道类型为sp2,故答案为:sp2;
=3,所以碳原子杂化轨道类型为sp2,故答案为:sp2;
③. 根据价层电子对互斥理论,NH3的分子构型为三角锥形,属于极性分子,CO2的分子构型为直线形,属于非极性分子,N2的分子构型为直线形,属于非极性分子,H2O的分子构型为V形,属于极性分子,故答案为:bc;
(4). ①. 由晶胞示意图可知,在UO2的晶胞中U原子位于顶点和面心,O原子位于体心,每个晶胞中有4个O原子与U原子距离最近,每个面为2个晶胞共有,则晶胞中U原子的配位数为8,故答案为:8;
②. 由晶胞示意图可知,在UO2的晶胞中U原子位于顶点和面心,O原子位于体心,则每个晶胞中U原子的个数为8×![]() +6×
+6×![]() =4,O原子的个数为,即每个晶胞中含有4个UO2,所以UO2的密度为:
=4,O原子的个数为,即每个晶胞中含有4个UO2,所以UO2的密度为:![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓HNO3,在烧杯中放入用铜线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。下列有关说法正确的是( ) .

A. Fe比Pb活泼,始终作负极
B. Fe在浓HNO3中钝化,始终不会溶解
C. 电池停止工作时,烧杯中生成了Fe(NO3)3
D. 利用浓HNO3作电解质溶液不符合“绿色化学”思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJmol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196kJmol-1
H2(g)+![]() O2(g)═H2O(l)△H=-285kJmol-1
O2(g)═H2O(l)△H=-285kJmol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________________
(2)①在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl(氯化亚铜)沉淀,同时溶液的酸性增强.制备CuCl的离子方程式是___________
②在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,![]() ________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
③若在0.15![]() 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量![]() 气体,使
气体,使![]() 完全沉淀为CuS,此时溶液中的
完全沉淀为CuS,此时溶液中的![]() 浓度是______
浓度是______![]()
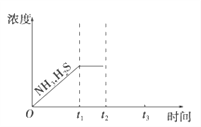
(3)工业上常用氨水吸收H2S进行废气脱硫,生成NH4HS。一定温度下1molNH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。下图1是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图1上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线_________________________。
(4)可利用H2S废气进行高温热分解制取氢气,实现化废为宝。
已知:![]()
在恒温密闭容器中,控制不同温度进行![]() 分解实验。以
分解实验。以![]() 起始浓度均为0.2
起始浓度均为0.2 ![]() 测定
测定![]() 的转化率,结果见下图。
的转化率,结果见下图。

图中a为![]() 的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时![]() 的转化率。据图计算985℃时
的转化率。据图计算985℃时![]() 按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将饱和FeCl3溶液滴入沸水时,液体变为红褐色,得到的是Fe(OH)3胶体。用此分散系进行实验:
(1)请写出制备Fe(OH)3胶体的化学方程式____________________________________________。
(2)证明有 Fe(OH)3 胶体生成的实验操作是用一束光照射此液体,可以看到有光亮的通路,利用的胶体性质是______________。
(3)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电源,通电一段时间后发现阴极附近颜色加深,这种现象叫_____。
(4)向Fe(OH)3 胶体中逐滴加入稀硫酸,可以看到有红褐色沉淀产生,因为胶体发生了_______,继续滴加稀硫酸直至过量,可以看到的实验现象是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s)+H2O(g)=CO(g)+H2(g) △H1=akJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=ckJ/mol
④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=dkJ/mol
A. 反应①、②为反应③提供原料气,且a>0
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)=1/2CH3OCH3(g)+1/2H2O(g) △H=d/2kJ/mol
D. 反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的△H=-(2b+2c+d)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比是( )
A.1:1
B.2:1
C.1:3
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 分散系中分散质粒子的大小:浊液>胶体>溶液
B. 验证烧碱溶液中是否含有Cl—,先加稀硝酸除去OH—,再加入AgNO3溶液,有白色沉淀,证明含Cl—
C. 标准状况下,任何气体的分子间距离几乎都相等
D. 金属氧化物都是碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com