

| △c |
| t |
| 0.75mol?L |
| 10min |


科目:高中化学 来源: 题型:
| A、Na、Mg、Al原子的最外层电子数依次减少 |
| B、Si、P、S元素的最高正价依次降低 |
| C、C、O、N的原子半径依次减小 |
| D、Li、Na、K的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素原子的最外层电子数为4 |
| B、其常见价态为+2、+4 |
| C、它的金属性比铅强 |
| D、它的原子半径比第115号元素的原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
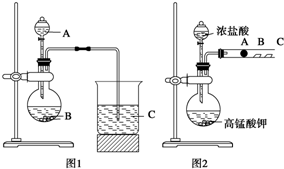 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在相对过量的氢氧化钠溶液中滴入少量硫酸铜溶液以配制氢氧化铜悬浊液 |
| B、在稀氨水中逐渐加入过量的硝酸银溶液来配制银氨溶液 |
| C、试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 |
| D、溴乙烷在氢氧化钠溶液的存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
| E、向较稀的KSCN和FeCl3的混合溶液中加入少量KCl固体,溶液颜色深浅不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com