
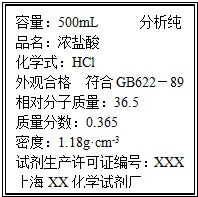
 ȡ����Ϊ13.7g��Na2CO3��NaHCO3�Ĺ��������100mL 2.00mol?L-1������ǡ����ȫ��Ӧ���ٷų����壮
ȡ����Ϊ13.7g��Na2CO3��NaHCO3�Ĺ��������100mL 2.00mol?L-1������ǡ����ȫ��Ӧ���ٷų����壮| 1000��w |
| M |
| 106g/mol��0.05mol |
| 13.7g |
| 1000��1.18��36.6 |
| 36.5 |
| 2.00mol/L��0.1L |
| 11.8mol/L |
| 22.4L��0.1mol |
| 1mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.08mol?L-1 |
| B��0.12 mol?L-1 |
| C��0.05 mol?L-1 |
| D��0.14mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ʵ���Ũ�ȵ�NaHCO3��Һ��Ba��OH��2��Һ���ʱ������Ӧ��HCO3-+Ba2++OH-=BaCO3��+H2O | ||||
| B����AlCl3��Һ�м��������ˮ��Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
C����ͭ���缫���������Һ��2H2O
| ||||
| D������������Һ��ϡ���ᡢ���������ϣ�Fe2++2H2O2+4H+=Fe3++4H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 3 |
| 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.40 | |
| t2 | 0.80 |
| A����Ӧ��t1min�ڵ�ƽ������Ϊv��H2��=��0.10/t1 ��mol?L-1?min-1 |
| B�����������������䣬��ƽ����ϵ����ͨ��0.60 molCO��1.20 molH2O������ƽ��ʱ��c��CO2��=0.90 mol?L-1 |
| C�����������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O��g������ԭƽ����ȣ��ﵽ��ƽ��ʱCOת�������� |
| D���¶�����850�棬������Ӧ��ƽ�ⳣ����Ϊ0.85����÷�Ӧ������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ����\Ԫ�� | 8O | 16S | 34Se | 52Te |
| �����۵㣨�棩 | -218.4 | 113 | 450 | |
| ���ʷе㣨�棩 | -183 | 444.6 | 685 | 1390 |
| ��Ҫ���ϼ� | -2 | -2��+4��+6 | -2��+4��+6 | |
| ԭ�Ӱ뾶 | ������ | |||
| ������H2��Ӧ��� | ��ȼʱ���� | ���Ȼ��� | �����ѻ��� | ����ֱ�ӻ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ�Ӱ뾶��С˳��Ϊ��B��C��D��A |
| B������Ԫ�ض����ڷǽ���Ԫ�أ�����֮��ֻ���γɹ��ۻ����� |
| C��B��CԪ��λ��Ԫ�����ڱ��еڶ����ڣ�DԪ��λ��Ԫ�����ڱ��е������� |
| D��BA4��CA4+��������������������ṹ��B��C��D����Ԫ�ض������ڷ��Ӿ��塢ԭ�Ӿ����ͬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
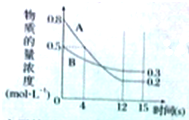 ��֪����ӦaA��g��+bB��g��?cC��g��ij�¶��£���2L���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ��
��֪����ӦaA��g��+bB��g��?cC��g��ij�¶��£���2L���ܱ�������Ͷ��һ������A��B��������������ʵ���Ũ����ʱ��仯��������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com