
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| A、苯的硝化反应;乙烯使溴水褪色 |
| B、葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯 |
| C、乙醇和乙酸制乙酸乙酯;乙烷和氯气制氯乙烷 |
| D、乙醇和氧气制乙醛;苯和氢气制环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
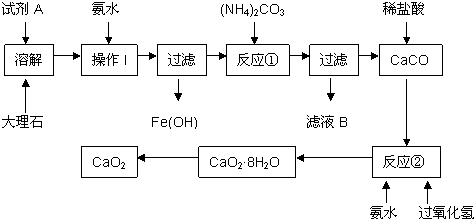
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
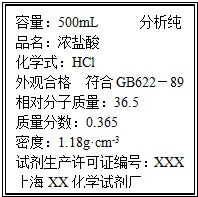 取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8g | B、5.6g |
| C、8.4g | D、11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| B | ||
| A | C |
| A、A为ⅤA族元素 |
| B、B为第二周期的元素 |
| C、C是周期表中化学性质最活泼的非金属 |
| D、三种元素都为非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com