
| A、苯的硝化反应;乙烯使溴水褪色 |
| B、葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯 |
| C、乙醇和乙酸制乙酸乙酯;乙烷和氯气制氯乙烷 |
| D、乙醇和氧气制乙醛;苯和氢气制环己烷 |


科目:高中化学 来源: 题型:
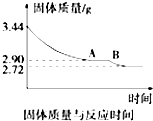 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、元素Z、W的简单离子的电子层结构不同 |
| C、元素Y的简单气态氢化物的热稳定性比Z的强 |
| D、只含X、Y、Z三种元素的化合物,可能是离子化台物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤 | B、加热 | C、蒸馏 | D、溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.08mol?L-1 |
| B、0.12 mol?L-1 |
| C、0.05 mol?L-1 |
| D、0.14mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为NA |
| B、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、22.4L氖气所含有的原子数目为NA |
| D、常温常压下,14g N2含有分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ |
| B、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ |
| C、NaHCO3溶液与稀H2SO4反应:HCO3-+H+═H2O+CO2↑ |
| D、向FeCl3溶液中加入Ba(OH)2:3Ba(OH)2+2Fe3+═2Fe(OH)3+3Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com