
A、B、C、D、E是同一周期的五种主族元素,A与B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的还原性为D>C;五种元素的原子得失电子后所形成的简单离子中E的离子半径最小,则它们的原子序数由小到大的的顺序为( )
A.BAEDC B.CDBAE C.ABCDE D.ECDBA
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
C,N,S都是重要的非金属元素。下列说法正确的是( )
A.三者对应的氧化物均为酸性氧化物
B.三者的单质直接与氧气反应都能生成两种以上氧化物
C.同浓度的Na2CO3、NaNO3、Na2SO3溶液的pH:NaNO3<Na2SO3<Na2CO3
D.CO2、NO2、SO2都能与H2O反应,其反应原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或者验证气体性质的装置图
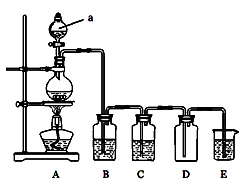
(1) 写出用A制取氯气的化学方程式
(2) 利用上图装置制备纯净、干燥的氯气,并证明氧化性:Cl2>Fe3+
装置B中的溶液的作用为_________________;
装置D中加的最佳试剂为(填序号)________________。
供选试剂:a、浓硫酸 b、FeCl2溶液 c、KSCN与FeCl2的混合溶液
d、无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具有氧化性和漂白性:B中为少量Na2S溶液、C中为品红溶液,D中应加入足量的____________(填溶液名称),E中加入____________溶液(填化学式)
(4)证明碳元素的非金属性比硅元素的强的现象为_________________
实验2不严谨之处应如何改进
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中不能一步实现的是( )
A. H2SiO3 → SiO2 B. SiO2 → H2SiO3
C. Si → SiO2 D. SiO2 → Si
查看答案和解析>>
科目:高中化学 来源: 题型:
生活处处有化学,下列说法正确的是
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中一定只有共价键
C.W、X、Z三种元素最高价氧化物对应水化物的酸性逐渐减弱
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2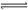 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|
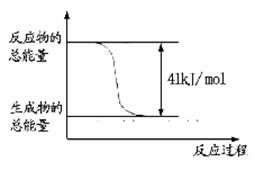
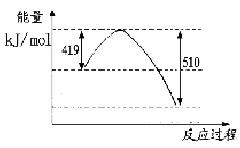
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
该反应的△S____0(填“>”或“<”或“=”),在 ______情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是 __ (选填编号)。
A.3v正(H2)=v逆(CO2) B.C(H2) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
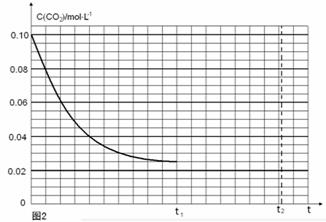
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示。保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com