
已知温度T时,水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= 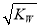 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列水溶液一定呈碱性的是
A.pH=8的溶液 B.含有OH-离子的溶液
C.NaCl溶液 D.c(OH-)>c(H+)的溶液
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
把Ca(0H)2放入蒸馏水中,—段时间后达到平衡:
下列说法正确的是( )。
A.向溶液中加CaO,并恢复原温度时,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(0H)2固体质量不变
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:填空题
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。
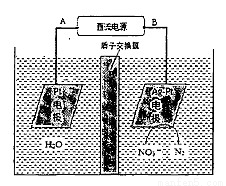
①电源正极为 (填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列实验误差分析错误的是
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值偏小
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
25oC时,amol·L-1一元酸HA溶液与b mol·L-1 NaOH溶液等体积混合后,pH为7,则下列关系一定正确的是
A.a=b B.a>b C.c(A-)=c(Na+) D.c(A-)<c(Na+)
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:选择题
在密闭容器中的一定量混合气体发生反应: 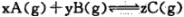 平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
A.B的转化率降低
B.x+y<z
C.平衡向正反应方向移动
D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:填空题
我国从1994年起在食盐中添加碘酸钾(KIO3)作为营养强化剂。请回答:
(1)成人如果长期缺碘,会引起的病症是 (填字母)。
A.佝偻病 B.甲状腺肿大 C.夜盲症
(2)在瘦肉、胡萝卜、海带中,富含碘元素的是 。
(3)依据化学方程式为:5KI+KIO3+6HCl = 6KCl+3I2 +3H2O可检验加碘盐中是否含有碘。此反应中的还原剂是 (填化学式),生成的含I2的溶液遇淀粉可变为 色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com