
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
(1) ③⑤(2分)
(2)c(Na+)>c(HCO3―)>c(OH―)>c(CO32―)(2分)
HCO3― + H2O H2CO3 + OH―(1分)
H2CO3 + OH―(1分)
(3)① HA是弱酸(1分);② 大于(1分);等于(1分);③ 10 -5(2分)
【解析】
试题分析:(1)CH3COOH、H2O部分电离,为弱电解质。
(2)0.1 mol·L-1NaHCO3溶液的pH大于8,说明HCO3?的水解程度大于电离程度,所以离子浓度由大到小的顺序为:c(Na+)>c(HCO3―)>c(OH―)>c(CO32―);HCO3?水解生成H2CO3,离子方程式为:HCO3― + H2O H2CO3 + OH―
H2CO3 + OH―
(3)① 等体积、等浓度的HA和NaOH恰好反应,生成NaA,溶液的pH为9,说明NaA水解显碱性,则HA为弱酸。
②因为恰好完全反应时溶液显碱性,所以溶液为中性时,HA过量,即c(HA)大于0.2mol?L?1;根据电荷守恒可得:c(H+)+c(Na+)=c(OH?)+c(A-),因为H+浓度等于OH?浓度,所以c(A-)=c(Na+)。
③水电离出的c(OH-)=10-14÷10-9mol/L= 10 -5mol/L
考点:本题考查弱电解质的判断、离子浓度比较、方程式的书写、离子浓度的计算。


科目:高中化学 来源:2015届江苏省扬州市高二上学期期末考试化学试卷(必修)(解析版) 题型:填空题
下图所示的物质转化关系中,各物质均为短周期主族元素组成的单质或化合物。已知:A、C、D、F、K均为单质;C、E、F、G、K常温下是气体,且K为工业上制造漂白粉的原料之一;J为白色沉淀且既能溶于B的水溶液,又能溶于E的水溶液;B、G可以使湿润的红色石蕊试纸变蓝;反应④是工业制化肥的重要反应之一。(图中部分反应条件及物质未列出)
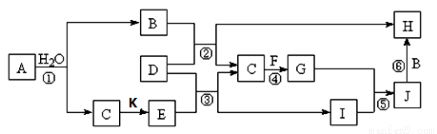
请回答下列问题:
(1)B的电子式为 。
(2)H的化学式为 。
(3)写出反应④的化学方程式 。
(4)写出反应⑤的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届山西省大同市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
① pH=2和pH=1的HNO3中c(H+)之比为1∶10
②Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
③同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
④分别向100 mL 0.1 mol·L-1的醋酸和10 mL 1.0 mol·L-1的醋酸中加入KOH,恰好中和所需的KOH一样多
A.①④ B.①③④ C.①② D.①②③
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高二3月质检化学试卷(解析版) 题型:选择题
把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液 B.CH3COOH C.稀HNO3 D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高二3月质检化学试卷(解析版) 题型:选择题
某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是
A.②③ B.③⑥ C.①④ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下反应2AB(g)  A2(g) +B2(g),不能确定达到平衡状态的是
A2(g) +B2(g),不能确定达到平衡状态的是
A.单位时间内生成n mol A2,同时生成2n molAB
B.单位时间内生成n mol B2,同时生成2n molAB
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的物质的量分数不随时间变化
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.常温下,0.01mol·L-1醋酸溶液pH=2
B.95℃纯水的pH<7,说明加热可导致水呈酸性
C.常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4
D.常温下,将0.2 mol·L-1的盐酸与等体积水混合后溶液pH=1
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
已知温度T时,水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= 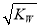 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com