
����Ŀ����1����֪2 mol����ȼ������Һ̬ˮʱ�ų�572 kJ����������Ӧ����ʽ��2H2(g)+O2(g)![]() 2H2O(l)����ش��������⣺
2H2O(l)����ش��������⣺
���÷�Ӧ�������������ܺ�____________(����ڡ�����С�ڡ����ڡ�)��Ӧ�������ܺ͡�
����2 mol������ȫȼ������ˮ��������ų�������_________(�>����<����=��)572 kJ��
��2��FeS2���ղ�����SO2�����������ᡣ��֪25 ����101 kPaʱ��
2SO2(g)+O2(g)![]() 2SO3(g) ��H1=197 kJ��mol1
2SO3(g) ��H1=197 kJ��mol1
H2O(g)![]() H2O(l) ��H2=44 kJ��mol1
H2O(l) ��H2=44 kJ��mol1
2SO2(g)+O2(g)+2H2O(g)![]() 2H2SO4(l) ��H3=545 kJ��mol1
2H2SO4(l) ��H3=545 kJ��mol1
��SO3(g)��H2O(l)��Ӧ���Ȼ�ѧ����ʽ��____________________________��
��3����֪���з�Ӧ���Ȼ�ѧ����ʽ��
��6C(s)+5H2(g)+3N2(g)+9O2(g)![]() 2C3H5(ONO2)3(l) ��H1
2C3H5(ONO2)3(l) ��H1
��2H2(g)+O2(g)![]() 2H2O(g) ��H2
2H2O(g) ��H2
��C(s)+O2(g)![]() CO2(g) ��H3
CO2(g) ��H3
��Ӧ4C3H5(ONO2)3(l)![]() 12CO2(g)+10H2O(g)+O2(g)+6N2(g)�Ħ�HΪ___________��
12CO2(g)+10H2O(g)+O2(g)+6N2(g)�Ħ�HΪ___________��
���𰸡���1����С�� ��<
��2��SO3(g)+H2O(l)![]() H2SO4(l) ��H=130 kJ��mol1
H2SO4(l) ��H=130 kJ��mol1
��3��12��H3+5��H22��H1
����������1������Ӧ2H2(g)+O2(g)![]() 2H2O(l) ��H=572 kJ��mol1 �Ƿ��ȷ�Ӧ���ʸ÷�Ӧ�������������ܺ�С�ڷ�Ӧ�������ܺ͡����������Ϣ��֪��2 mol������ȫȼ������Һ̬ˮ�ų�����572 kJ����Һ̬ˮ���ˮ������Ҫ��������������2 mol������ȫȼ������ˮ����ʱ�ų�������С��572 kJ��
2H2O(l) ��H=572 kJ��mol1 �Ƿ��ȷ�Ӧ���ʸ÷�Ӧ�������������ܺ�С�ڷ�Ӧ�������ܺ͡����������Ϣ��֪��2 mol������ȫȼ������Һ̬ˮ�ų�����572 kJ����Һ̬ˮ���ˮ������Ҫ��������������2 mol������ȫȼ������ˮ����ʱ�ų�������С��572 kJ��
��2������д��SO3��ˮ��Ӧ�Ļ�ѧ����ʽ��ע�������ʵ�״̬��SO3(g)+H2O(l)![]() H2SO4(l)��Ȼ����ݸ�˹���������Ӧ�ȣ���H=
H2SO4(l)��Ȼ����ݸ�˹���������Ӧ�ȣ���H=![]() ��H2+
��H2+![]() =130 kJ��mol1������д���Ȼ�ѧ����ʽ��SO3(g)+H2O(l)
=130 kJ��mol1������д���Ȼ�ѧ����ʽ��SO3(g)+H2O(l)![]() H2SO4(l) ��H=130 kJ��mol1��
H2SO4(l) ��H=130 kJ��mol1��
��3�����ø�˹������ã���H=12��H3+5��H22��H1��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʵ����������������
A. Ϩ��ƾ���ʱ���õ�ñ���𣬶��Ҹ�����
B. ���Թ���Һ����ȣ�Һ��Ӧ�������Թ��ݻ�������֮һ
C. ���Թܼ���ʱ��Ӧ������ס�ԹܼеĶ̱�
D. �Թ�ϴ�Ӹɾ���Ҫ�ܿ����£��������Թܼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1����״����11.2L NH3�к�_________�������ӣ�_____________mol��ԭ�ӡ�
��2����������SO2��SO3���ʵ���֮����_____________����������ԭ�Ӹ���֮����________��
��3����0.4mol A13+��Al2��SO4��3��������SO42�������ʵ�����__________��
��4����һ�����¶Ⱥ�ѹǿ�£�1�������X2��3�������Y2��������2����������û�����Ļ�ѧʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
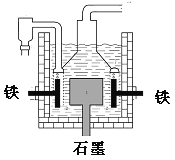
����Ŀ������1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ���Ӧԭ��Ϊ��4NaOH��������=4Na+O2��+2H2O���������� ����������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ��3Fe+4NaOH=Fe3O4+2H2��+4Na���������й�˵����ȷ������ ��
A��������������������ƣ����������缫��ӦΪ��Na++e-=Na
B�����������˷�����ԭ�����������Ļ�ԭ�Ա���ǿ
C������ά������������˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ���������Ϊ2:l
D��Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ���������ͼ����������ʯī��Ϊ��������Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����Ϊ2 L���ܱ������н��з�Ӧ��2A(g)![]() 3B(g)��C(g)������Ӧ����ǰ20 s��3 mol��Ϊ1.8 mol����ǰ20 s��ƽ����Ӧ����Ϊ( )
3B(g)��C(g)������Ӧ����ǰ20 s��3 mol��Ϊ1.8 mol����ǰ20 s��ƽ����Ӧ����Ϊ( )
A. v(B)��0.03 mol��L��1��s��1
B. v(B)��0.045 mol��L��1��s��1
C. v(C)��0.03 mol��L��1��s��1
D. v(C)��0.06 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȼ�ϼ�С��Ⱦ���ϡ���ɫ���ˡ�������й���ȼ�ϵ�˵����ȷ���ǣ�������
A. ����ȼ�����ǽ�ˮ��Ϊ�͵�����ȼ��
B. �����Ǿ�����ֵ�ߡ�����Ⱦ���ŵ��ȼ��
C. �Ҵ��DZ���������������������ȼ��
D. ʯ�ͺ�ú�ǹ�������ʹ�õĿ������Ļ�ʯȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������98%��Ũ����(g��1.84g��cm��3)���Ƴ�Ũ��Ϊ0.5mol��L��1��ϡ����500ml��
(1)ѡ�õ���Ҫ�����У�
��________����_________����__________����__________����____________��
(2)�뽫���и�����������ȷ��������ں����ϡ�
A������Ͳ��ȡŨH2SO4 B�������ߵ�ҡ��
C���ý�ͷ�ιܼ�����ˮ���̶��� D��ϴ����������
E��ϡ��ŨH2SO4 F������Һת������ƿ
�������ȷ��˳������Ϊ____________________________��
(3)��Ҫ�ش��������⣺
������Ũ��������Ϊ____________mL��
�����ʵ������15mL��20mL��50mL����ͲӦѡ��____________mL����Ͳ��ã���ȡʱ������Ͳ���ɾ���ˮϴ����ֱ����ȡ��ʹŨ��__________(��ƫ��������ƫ����������Ӱ����)
�۽�Ũ�������ձ��ڱ�����ע��ʢˮ���ձ��У����ò��������Ͻ����Ŀ����____________���������������Һ�彦�������ʹŨ��ƫ____________��
����ת������ƿǰ�ձ���Һ��Ӧ____________�������ʹŨ��ƫ____________����ϴ���ձ��Ͳ�����2��3�Σ�ϴ��ҺҲҪת������ƿ�������ʹŨ��____________��
�ݶ���ʱ����ʹ��Һ��Һ����̶������У������ӻ�ʹŨ��____________��������ʹŨ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����34.2g Al2(SO4)3 ��������ˮ���100mL��Һ��
��1��д��Al2(SO4)3��ˮ��Һ�еĵ��뷽��ʽ��__________________________________��
��2������Һ��Al2(SO4)3�����ʵ���Ũ��Ϊ________________________��
��3���Ӹ���Һ��ȡ��10mL������SO42�� �����ʵ���Ũ��Ϊ____________________��
��4���Ӹ���Һ��ȡ��10mL��ϡ�͵�100mL��ϡ�ͺ���Һ������Al2(SO4)3�����ʵ���Ũ��Ϊ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
��1��������NaHSO4��Ba(OH)2����Һ�а������ʵ���֮��2��1��ϣ����ӷ���ʽΪ________����ʱ��Һ��________�ԡ�
������NaHSO4��Ba(OH)2����Һ�а������ʵ���֮��1��1��ϣ����ӷ���ʽΪ________����ʱ��Һ��________�ԡ�
��2���������ܽ���˳�ȥ���������ʺ�����Һ�����εμӹ���NaOH��Һ��BaCl2��Һ��Na2CO3��Һ��ֱ�����ٲ�����������Щ������Ŀ����________���μ�Na2CO3��Һʱ������Ӧ�Ļ�ѧ����ʽΪ___________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com