
【题目】一定条件下,向可变容积的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡后,容器的体积为4L,试回答下列问题:
2NH3(g) △H<0达到平衡后,容器的体积为4L,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K = ,若降低温度,K值将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将___(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将 (填“增大”“减小”或“不变”),理由是___________________________。
(3) 达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将________(填“增大”、“减小”或“不变”)。
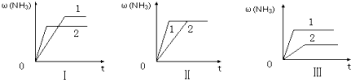
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图。下列说法正确的是 (填序号)。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2
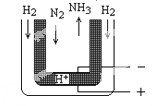
(5)常压下,把H2和用He稀释的N2分别通入一个570℃的电解池装置(下图),H2和N2便可在电极上合成氨,装置中的电解质(图中黑细点处)能传导H+,则阴极的电极反应式为___________。
【答案】(1)c2(NH3)/c(N2)·c3(H2),增大;
(2)正,不变,K只与温度有关;
(3)减小;
(4)b;
(5)N2+6e-+6H+=2NH3。
【解析】
试题分析:(1)化学平衡常数:一定条件下,生成物浓度的幂之积和反应物浓度的幂之积,K=c2(NH3)/c(N2)·c3(H2),K只受温度的影响,此反应是放热反应,降低温度,平衡向正反应方向移动,K增大;
(2)缩小容器的体积,增大压强,平衡向正反应方向移动,平衡常数不变,因为平衡常数K只受温度的影响;
(3)恒压下,充入非反应气体,容器体积扩大,各组分的浓度减小,根据勒夏特列原理,平衡应向逆反应方向移动,氮气的转化率减小;
(4)a.根据勒夏特列原理,增大压强,平衡向正反应方向移动,压强越大,NH3的体积分数越大,故错误;b.催化剂只加快反应速率,对化学反应平衡无影响,故正确;c.此反应属于放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向进行,温度越高,NH3的体积分数越小,故错误;
(5)阴极是得电子,化合价降低,根据装置图,N的化合价降低,N2在阴极上放电,电极反应式为N2+6H++6e-=2NH3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合成涤纶的流程图如下所示。
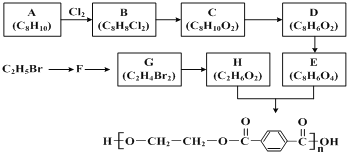
回答下列问题:
(1)B 中官能团的名称是___________________;G的名称是________________;
(2)C→D 的反应类型是________________;
(3)E与 H 反应的化学方程式为________________;
(4)下列说法正确的是_______________;
A.化合物D能发生银镜反应
B.化合物A~D均属于芳香烃
C.反应G→H属于消去反应
D.化合物D能与3molH2发生加成反应
E.化合物C、H、E均能与金属钠反应放出氢气
(5)E有多种同分异构体,符合下列条件的同分异构体有_______种,其中在核磁共振氢谱中出现四组峰的是__________________________________(写出结构简式)。
①芳香族化合物;②红外光谱显示含有羧基;③能发生银镜反应;④能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15g铁和氧化铁的混合物中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
(1)混合物中铁的质量为 g
(2)稀H2SO4的物质的量浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数比内层电子总数少4 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 与氢形成的气态化合物在标准状况下的密度为0.76g·L-1 |
Z | 元素最高正价与负价的绝对值之差是6 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是 ,在周期表中的位置是 。
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式 。
(3)写出元素X、T形成的化合物XT2的电子式 。
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O反应中,
CuSO4 + SO2↑+ 2H2O反应中,
(1) 元素被氧化, 是氧化剂,还原产物是 。
(2)用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
(3)若有2mol的H2SO4参与反应,则被还原的H2SO4为 g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe 2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe 3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+ =4Fe3+ +2H2O,则另一反应的离子方程式为_________________;
(2)草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:
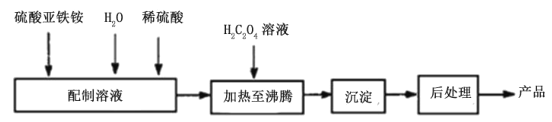
①配制(NH4) 2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是___________________。
②得到的草酸亚铁沉淀需充分洗涤,洗涤操作的具体方法为_________________________________,检验是否洗涤干净的方法是___________________________。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A→B发生反应的化学方程式为:__________________________________。
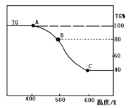
②已知 B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式____________;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g 样品,溶于少量2mol/L 硫酸中并用 100mL 容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V 1 mL。
Ⅲ.向上述溶液中加入足量 Zn 粉,使溶液中的 Fe3+恰好全部还原为 Fe2+。
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V 2 mL。
已知:2MnO4- +5H2C2O 4+6H+=2Mn2+ +10CO2+8H2O
MnO4- +8H++5Fe2+ =5Fe3+ + Mn2+ +4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量(填―偏大‖、―偏小‖或―不变‖)。
②mg样品中草酸根离子的物质的量为(用 c,V1,V2的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的 ΔH>0
2AB3(g)”的 ΔH>0
B. 图②表示压强对可逆反应 2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医疗上绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
Ⅰ.【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备 FeSO4 7H2O晶体,步骤如下:

(1)预处理:先将废铁屑加入到饱和 Na2CO3溶液中洗涤,目的是__________ ,然后将废铁屑用水洗涤 2~3 遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2
(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为__________ 。实验室常用铁氰化钾溶液检验反应生成的Fe2+,写出该反应的离子反应方程式:______________;
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,冷却结晶,滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
Ⅱ.【测定FeSO4 7H2O 含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,准确量取 25.00mL 该液体于锥形瓶中,用 0.1000mol/L KMnO4标准溶液滴定滴定3次,平均消耗 10.00mL标准液,该样品中 FeSO4 7H2O 的质量分数为________ 。(已知 Mr(FeSO4 7H2O)=278)。
(2)若测量结果偏小,则可能是在定容时________(填“俯视”或“仰视”)读数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:
①溶解样品改用了硫酸,而不用盐酸,为什么 。

②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com