
����Ŀ��ҽ�����̷�(FeSO47H2O)������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽����
�������Ʊ���Ʒ��
��С���ɷ���м(����������ͭ��������������)������ͼ��ʾװ���Ʊ� FeSO4 7H2O���壬�������£�

��1��Ԥ�������Ƚ�����м���뵽���� Na2CO3��Һ��ϴ�ӣ�Ŀ����__________ ��Ȼ����м��ˮϴ�� 2��3 �顣
��2����ϴ�Ӻ�ķ���м���뵽Բ����ƿ�У�������ͨ��N2
��3���ټ�������ϡ���ᣬ�����¶� 50����80��֮�䣬��ַ�Ӧ��Բ����ƿ��ʣ��Ĺ���Ϊ__________ ��ʵ���ҳ������軯����Һ���鷴Ӧ���ɵ�Fe2+��д���÷�Ӧ�����ӷ�Ӧ����ʽ��______________��
��4����ȡ��Ʒ����������3���з�Ӧ��Ļ�����м�����������ˮ�����ȹ��ˣ���ȴ�ᾧ���˳����壬��������ˮϴ�� 2��3 �Σ�������ֽ���������ɣ��ܱձ��档
�������ⶨFeSO4 7H2O ������
��1����ȡ������Ʒ 10.0g������������ϡ�����У���� 100mL ��Һ��ȷ��ȡ 25.00mL ��Һ������ƿ�У��� 0.1000mol/L KMnO4����Һ�ζ��ζ�3�Σ�ƽ������ 10.00mL��Һ������Ʒ�� FeSO4 7H2O ����������Ϊ________ ��(��֪ Mr(FeSO4 7H2O)=278)��
��2�����������ƫС����������ڶ���ʱ________(����ӡ������ӡ�)������
���𰸡�������1��ϴȥ��м���������
��3��Cu 3Fe2+ +2Fe(CN)63- = Fe3[Fe(CN)6]2 ��
������1��55.6%��2������
��������
���������������1��̼���Ƶ�ˮ��Һ�Լ��ԣ����Գ�ȥ��м��������ۣ�
��3������ͭ�������������ᷴӦ��������ͭ����������������������ͭ����������Ӧ��������������ͭ���ʣ������軯����Һ���鷴Ӧ���ɵ�Fe2+������ɫ�������ɣ�������Ӧ�����ӷ�Ӧ����ʽΪ3Fe2+ +2Fe(CN)63- = Fe3[Fe(CN)6]2 �� ��
���� �ⶨ��Ʒ��Fe2+�ĺ���������������������KMnO4��Һ�ζ���Fe2+��Fe3+����Ԫ�ػ��ϼ�����1�ۣ�MnO4-��Mn2+����Ԫ�ؽ���5�ۣ����ϼ�������С������Ϊ5����Fe2+ϵ��Ϊ5��MnO4- ϵ��Ϊ1������Ԫ���غ��֪Mn2+��Fe3+ϵ���ֱ�Ϊ1��5�����ݵ���غ��֪ȱ��ΪH+��H+��ϵ��Ϊ2+3��5-[2��5-1]=8������HԪ���غ��֪H2Oϵ����4�����Է�Ӧ���ӷ���ʽΪ5Fe2++MnO4-+8H+=1Mn2++5Fe3++4H2O��
��Fe2+�����ʵ���Ϊxmol����
5Fe2+������������MnO4-��
5 1
xmol 0.01L��0.1mol/L
����x=![]() =0.005mol��
=0.005mol��
������Ʒ��FeSO47H2O������0.005mol��4��278g/mol=5.56g������4g��Ʒ��FeSO47H2O����������Ϊ![]() ��100%=55.6%��
��100%=55.6%��
��4������ʱ�������ƫ��Ũ��ƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiCl4�����������Ѻ��Ѱ�ԭ�ϣ���ҵ����Ҫ��TiO2�Ȼ��ķ�������ȡ��ij��ѧʵ��С����8.0g TiO2������ CCl4Ϊԭ����ȡTiCl4��װ��ͼ���£�
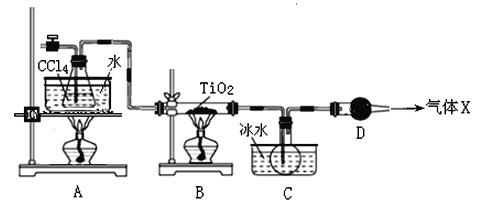
�±����й����ʵ����ʣ�
���� | �۵�/�� | �е�/�� | ���� |
CCl4 | ��23 | 76.8 | ��TiCl4���� |
TiCl4 | ��25 | 136 | ����ʪ������������ |
��ش���������
��1��TiCl4�л�ѧ���������� ��
��2��B��TiO2������Ӧ�Ļ�ѧ����ʽ�� ��
��3��X�������Ҫ�ɷ��� ��
��4��ʵ�鿪ʼʱ�ȵ�ȼA���ľƾ��ƣ���C����ƿ����Һ�γ���ʱ�ٵ�ȼB���ľƾ��ƣ�����ҪĿ���� ��
��5��������Cװ���е�TiCl4��Ӧ���õ�ʵ�����Ϊ ����������ƣ���
��6��������Ӧ���������ɵ�����Xȫ��ͨ�뵽��ͼ��ʾ��װ���г�ַ�Ӧ�����ɵ����� ���ѧʽ���������ε������ʵ���n�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
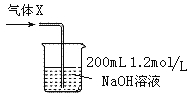
����Ŀ��һ�������£���ɱ��ݻ����ܱ�������ͨ��N2��H2��������Ӧ��N2(g)��3H2(g)![]() 2NH3(g) ��H��0�ﵽƽ������������Ϊ4L���Իش��������⣺
2NH3(g) ��H��0�ﵽƽ������������Ϊ4L���Իش��������⣺
��1���������£���Ӧ��ƽ�ⳣ������ʽK �� ���������¶ȣ�Kֵ�� ������������������С����������������
��2���ﵽƽ����������������䣬�����������Сһ�룬ƽ�⽫___���������淴Ӧ����������������Ӧ�����������������ƶ���ƽ�ⳣ��K�� ����������������С����������������������___________________________��
��3�� �ﵽƽ����ں�ѹ�����£���������ͨ�뺤��(He)��������ת���ʽ�________������������������С����������������
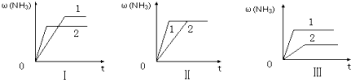
��4����������ͬ�������и�����1 molN2��3molH2���ڲ�ͬ�����·ֱ�ﵽƽ�⣬���������������ʱ��仯��ͼ������˵����ȷ���� ������ţ���
a��ͼ�������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1
b��ͼ��������ͬ��ͬѹ�´����Է�Ӧ��Ӱ�죬�Ҵ�����1��2
c��ͼ�������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2
��5����ѹ�£���H2����Heϡ�͵�N2�ֱ�ͨ��һ��570���ĵ���װ�ã���ͼ����H2��N2����ڵ缫�Ϻϳɰ���װ���еĵ���ʣ�ͼ�к�ϸ�㴦���ܴ���H+���������ĵ缫��ӦʽΪ___________��
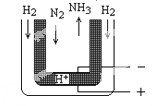
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱAgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ��t��ʱAgCl��Ksp��4��10��10������˵������ȷ����
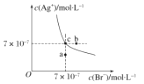
A����t��ʱ��AgBr �� KspΪ4.9��10��13
B���� t ��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)��ƽ�ⳣ�� K��816
AgBr(s)��Cl��(aq)��ƽ�ⳣ�� K��816
C��ͼ��a���Ӧ����AgBr�IJ�������Һ
D���� AgBr ������Һ�м���NaBr���壬��ʹ��Һ��c��䵽b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɺϳ����Ʊ��Ҵ�һ�������ַ�����
��1��ֱ�Ӻϳɷ���2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) ��H1
CH3CH2OH(g) + 3H2O(g) ��H1
��2CO(g) +4H2(g) ![]() CH3CH2OH(g) +H2O(g) ��H2= -253.6kJ��mol-1
CH3CH2OH(g) +H2O(g) ��H2= -253.6kJ��mol-1
��2����Ӻϳɷ�
�ϳ�����Ӧ���ɶ����ѣ�CH3OCH3�����������ʻ�����������������������������õ��Ҵ�����������������ͼ��ʾ��
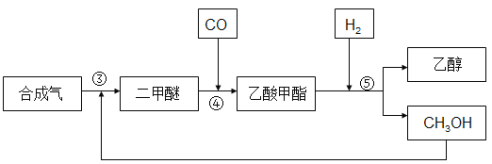
�� 3CO(g) + 3H2(g) ![]() CH3OCH3(g) + CO2 ��H3= -260.2kJ��mol-1
CH3OCH3(g) + CO2 ��H3= -260.2kJ��mol-1
�� CH3OCH3(g) + CO(g) ![]() CH3COOCH3(g)
CH3COOCH3(g)
�ش�����������
��1����5MPa����ʼͶ����n(H2):n(CO2)=3��1ʱ����ò�ͬ�¶�ʱ��Ӧ���и����ʵ�ƽ�������ͼ1��ʾ��
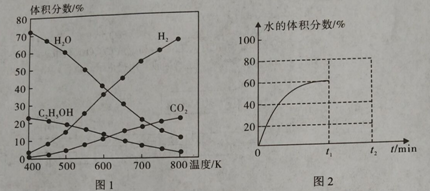
�ٷ�Ӧ�ٵġ�H1 0����S 0�����>������<����=����
����֪CO(g) + H2O(g) ![]() CO2(g) + H2(g) ��H= -41 kJ��mol-1������H1= ��
CO2(g) + H2(g) ��H= -41 kJ��mol-1������H1= ��
��500Kʱ����Ӧ�ﵽƽ�����t1minʱ���µ�600K����Ӧ��t2min���´ﵽƽ�⣬����ͼ2�л�����ϵ��ˮ�����������t1min��ı仯���ߡ�
��2���Է�Ӧ�۴��ڻ�ѧƽ��״̬ʱ����������ȷ���� ��������ĸ����
A��CO�ĺ������ֲ��� B��������CH3OCH3Ũ����CO2Ũ�����
C��3V����CO��=V��(CH3OCH3) D����ϵ���¶ȱ��ֲ���
��3����Ӻϳɷ��н��״���CH3OH��ѭ��ʹ�õ�Ŀ���� ��
��4����2Mpa��T��ʱ1L�ĺ��������У�����1.0mol���������2.0mol������������Ӧ�ݣ���t min��Ӧ�ﵽƽ�⣬������������ת����Ϊ75%���������ķ�Ӧ����v(H2)= ��ƽ�ⳣ��K= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������� Fenton ���������ɷ�Ϊ˫��ˮ�������Σ���Ҫ���Ի�������-Fenton��������ˮ�����л���Ⱦ�オ�������������������Ӧԭ����ͼ2��ʾ.���е��������H2O2��Fe2+����Fenton��Ӧ:Fe2++H2O2=Fe3++OH-+��OH�����ɵ��ǻ����ɻ�����OH�����л�������ǿ����������������˵����ȷ����

A.a���ǵ�Դ������
B.������ֻ��O2��Fe3+������ԭ��Ӧ
C.�����Ϸ����缫��Ӧ:H2O-e-=��OH+H+
D.����1molO2�����Բ���2mol��OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5���л���ѧ������
�����ɱ�(A)��һ���µĿ��������֢ҩ����ɻ�����B, C, D���л��ܼ���ͨ��
��������·�ߺϳɵõ���

��1��E�Ľṹ��ʽΪ ���京���������� ��д����)o
��2����C, D���ɻ�����F�ķ�Ӧ������ ��������C��������NaOH�Ҵ���Һ���ȷ�Ӧ�IJ����������
��3��H���ڰ����ᣬ��B��ˮ����ﻥΪͬ���칹�塣H����FeCl3��Һ������ɫ��Ӧ���ұ����ϵ�һ�ȴ���ֻ��2�֡�д��������������������H�Ľṹ��ʽ�� ��
��4���ϳ�F����Է�������Ϊ366��ʱ����������һ����Է�������Ϊ285�ĸ�����G��G��ʹĮˮ��ɫ��G�Ľṹ��ʽΪ
��5����֪��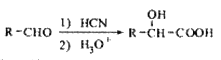 д����C�Ʊ�������
д����C�Ʊ������� �ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��¿��淴Ӧ��A(s)+2B(g)![]() 2C(g)+D(g)����H>0���ֽ�1molA��2molB����������У���4 molC��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ����
2C(g)+D(g)����H>0���ֽ�1molA��2molB����������У���4 molC��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ����

A�������¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1 mol A��2 mol B���ﵽ�µ�ƽ�����C��Ũ��������C��Ũ�ȵ�2��
B�����ֻ���λ�ò��䣬�����¶ȣ��ﵽ�µ�ƽ��ס�����B���������������
C�������¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��ﵽ�µ�ƽ�������C����������Ǽ���C�����������2��
D�������¶Ⱥ����е�ѹǿ���䣬t2ʱ�ֱ���ס����м���������ĺ����ס����з�Ӧ���ʱ仯����ֱ���ͼ2��ͼ3��ʾ(t1ǰ�ķ�Ӧ���ʱ仯��ʡ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڻ�ѧ��ҵ�����ż���㷺��Ӧ�á�
��1����1.25 mol��NO��NO2��N2O4��������NO���������Ϊ0.60��ͨ��ˮ�У��ڿ����������������ȫ��Ӧ��ɻ����������ʵ�����Χ��_______________��
��2����ϡ�����м���18.4 mol/L��Ũ���ᣨ98%������ˮ���������Ũ���ᣬ����Ũ���½���87%���ܶ�1.8 g/cm3������ʱ����ʧȥ��ˮ������50 mL 18.4 mol/L��Ũ������Ϊ��ˮ��ʱ��������ˮ__ g��
��3����65%��HNO3������m1���м���72%��Mg(NO3)2������m2�������ֱ�õ�97.5%��HNO3��60%��Mg(NO3)2��Һ�����в������ᣩ������������У����ᡢ����þ������ģ�H2O�����ռ��������5%��������ǰͶ�ϱ�![]() ��______________��
��______________��
��4�����Ṥҵ�е�β�����ռ�������ղ���ΪNaNO2��NaNO3��H2O�����к�0.50mol���������β����ǡ�ñ�һ������NaOH��Һ��ȫ���ա���֪��Ӧ����Һ����0.35molNaNO2������β��NO��NO2��ƽ�������NOx��ʾ����x = ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com