
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
【答案】D
【解析】
试题分析:从等效平衡的角度分析,4molC和2molD相当于2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态。A、保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,平衡向逆反应方向移动,达到平衡时,甲中C的浓度小于原来的2倍,即小于乙中C的浓度的2倍,故A错误;B、保持活塞位置不变,升高两个容器的温度,平衡向逆反应方向移动,甲、乙中B的质量分数都增大,故B错误;C、保持温度不变,移动活塞P,使乙的容积和甲相等,则乙容器内的压强增大,平衡向逆反应方向移动,达到新的平衡后,乙中C的体积分数小于甲中C的体积分数的2倍,故C错误;D、甲温度和体积变化,加入氦气后对平衡移动没有影响,保持温度和乙中的压强不变,加入氦气后乙体积增大,平衡应向正反应方向移动,正逆反应速率都减小,故D正确。故选D。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数比内层电子总数少4 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 与氢形成的气态化合物在标准状况下的密度为0.76g·L-1 |
Z | 元素最高正价与负价的绝对值之差是6 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是 ,在周期表中的位置是 。
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式 。
(3)写出元素X、T形成的化合物XT2的电子式 。
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医疗上绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
Ⅰ.【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备 FeSO4 7H2O晶体,步骤如下:

(1)预处理:先将废铁屑加入到饱和 Na2CO3溶液中洗涤,目的是__________ ,然后将废铁屑用水洗涤 2~3 遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2
(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为__________ 。实验室常用铁氰化钾溶液检验反应生成的Fe2+,写出该反应的离子反应方程式:______________;
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,冷却结晶,滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
Ⅱ.【测定FeSO4 7H2O 含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,准确量取 25.00mL 该液体于锥形瓶中,用 0.1000mol/L KMnO4标准溶液滴定滴定3次,平均消耗 10.00mL标准液,该样品中 FeSO4 7H2O 的质量分数为________ 。(已知 Mr(FeSO4 7H2O)=278)。
(2)若测量结果偏小,则可能是在定容时________(填“俯视”或“仰视”)读数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据及装置示意图如下:3![]() +8HNO3—→3
+8HNO3—→3![]() +8NO↑+7H2O
+8NO↑+7H2O

实验步骤如下:

Ⅰ.在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重。
请回答下列问题:
(1)装置b的名称为 ,使用时要从 (填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是
(2)本实验所用50%的硝酸的物质的量浓度为 ;实验中,氮氧化物废
气(主要成分为N02和NO)可以用NaOH溶液来吸收,其主要反应为:
2N02+2NaOH=NaN02+NaN03+H20和NO+N02+2NaOH=2NaN02+H20
其中NaOH溶液可以用Na2C03溶液来替代,请模仿上述反应,写出Na2C03溶液吸收的两个方程式:
;
(3)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是 。
(4)为了除去可能的杂质和减少产品损失,可分别用 和 洗涤晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请将括号中的杂质去除,依次写出除杂试剂和实验方法
例:CO2(HCl):饱和NaHCO3溶液,洗气。
①甲烷(乙烯):___________________,________。
②水(碘):___________________,________。
③HBr(Br2):___________________,________。
④溴苯(Br2):___________________,________。
⑤乙醇(乙酸):___________________,________。
⑥乙酸乙酯(乙酸):___________________,________。
Ⅱ.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关信息如下:
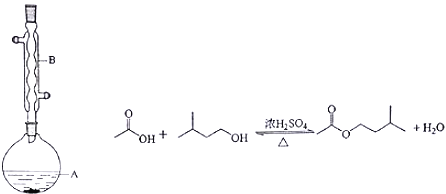
相对分子质量 | 沸点/℃ | 水中溶解度 | |
异戊醇 | 88 | 131 | 微溶 |
乙酸 | 60 | 118 | 溶 |
乙酸异戊酯 | 130 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是________________;
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层_________(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(3)本实验中加入过量乙酸的目的是_________________;
(4)实验中加入少量无水硫酸镁的目的是_________________;
(5)本实验的产率是____________。
A.30% B.40% C.50% D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 四种短周期元素在周期表中位于连续的四个主族,相对位置如图所示。Z元
素原子核外K层与M层电子数相等。下列说法正确的是
![]()
A. 原子半径由小到大的顺序为Y<X<W<Z
B. Y的单质和Z的单质能够发生反应
C. X的单质都是熔点高、硬度大的物质
D. 工业上利用电解Z、W的熔融氯化物的方法制备对应的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:
①溶解样品改用了硫酸,而不用盐酸,为什么 。

②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 。
(3)操作I的主要步骤为 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。m]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据及装置示意图如图表: ![]()
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |

实验步骤如下:
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸(密度为l.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V.粗产品经提纯后称重为5.7g
请回答下列问题:
(1)本实验所用50%的HNO3溶液物质的量浓度为 (保留一位小数),滴液漏斗中的细支管a作用是 。
(2)仪器b的名称为 ,其作用是 ,使用时要从 (填“上口”或“下口”)通入冷水。
(3)NaOH溶液的作用是 。溶液上方倒扣的漏斗的作用是 。
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是 。
(5)为了除去可能的杂质和减少产品损失,可分别用 和 洗涤晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com