
【题目】X、Y、Z、W 四种短周期元素在周期表中位于连续的四个主族,相对位置如图所示。Z元
素原子核外K层与M层电子数相等。下列说法正确的是
![]()
A. 原子半径由小到大的顺序为Y<X<W<Z
B. Y的单质和Z的单质能够发生反应
C. X的单质都是熔点高、硬度大的物质
D. 工业上利用电解Z、W的熔融氯化物的方法制备对应的单质
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同, A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1) B、C、D三种元素中电负性最大的元素其基态原子的电子排布图为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有________个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为______。该化合物的电子式为 。

(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 。
②由H分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬顿( Fenton )试例,成分为双氧水和亚铁盐,需要酸性环境。电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图2所示.其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+·OH,生成的羟基自由基(·OH)对有机物有极强的氧化能力。下列说法正确的是

A.a极是电源的正极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-=·OH+H+
D.消耗1molO2,可以产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol(C2H5O)3P=O分子中含有的σ键的数目为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:


解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为________pm,碳化硅的密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol·L -1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重复测定2次,所得的相关数据如下表:
测定 序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修22:化学生活与技术]氯碱工业过程中产生了大量的盐泥。某氯碱工厂的盐泥组成如下:
成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
该工厂进一步利用盐泥生产了七水硫酸镁,设计了工艺流程如图:

回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式 。
(2)在滤饼中检测到硫酸钙的成分,其原因是 。
(3)已知一些盐的溶解度如下图。在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在__________℃。

(4)步骤II操作是_______________,
(5)步骤III在工业上常用的设备是______________(填字母)。
A.加压干燥器 B.蒸馏塔 C.离心机 D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4·7H2O的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是人类生活中继铜、铁之后又一个重要的金属。工业上冶炼金属铝的原料来源于自然界中重要的矿物质钒土(主要成分:Al2O3;还有SiO2、Fe2O3、FeCO3、MgCO3等杂质)。从钒土中提取得到Al2O3的工艺流程如下图所示:

请回答下列问题:
(1)固体A所含物质的化学式(或分子式)是 。
(2)写出溶液A与足量气体B反应的离子方程式 。
(3)工业冶炼金属铝通常用石墨碳块作电解槽的阳极,请你根据电解原理解释电解冶炼铝的过程中,需要定期补充阳极碳块的原因 。
(4)Al2O3的熔点很高,因而在工业冶炼时,需将Al2O3熔于熔化的冰晶石(Na3AlF6)中进行电解。请写出电解过程中阴极的电极反应式 。工业上通常将Al(OH)3和Na2CO3一同溶于氢氟酸来制取冰晶石,反应时放出CO2气体,写出该反应的化学方程式 。
(5)有一位同学查阅资料发现,AlCl3的熔点很低。他提出:可通过电解熔融状态的AlCl3制取金属铝。你认为他提出的方案是否可行?为什么? 。
(6)某企业用上述工艺流程进行生产,每10.0t钒土可得到金属铝1.35t。如果不考虑生产过程的损耗,请你计算钒土中Al2O3的质量分数 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的同系物是人类最早认识的芳香族化合物,其中对二甲苯(英文名称p—xylene,缩写为PX)是化学工业的重要原料。
已知: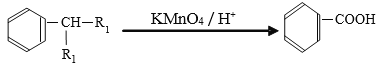
(1)写出PX的结构简式______________。
(2)PX可能发生的反应有__________、_____________。(填反应类型,只填两种。)
(3)有机物M存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

已知:M的分子式为C16H22O4,D能发生银镜反应。
①B的苯环上存在3 种不同化学环境的氢原子,则B 的结构简式是__________。
②D分子中所含的官能团是______________(填化学式)。
③M的结构简式是_______________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的对位二取代物; b.遇FeCl3溶液显示紫色; c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com