
【题目】【化学—选修5:有机化学基础】
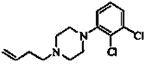
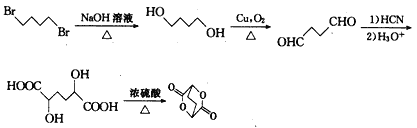
阿立呱陛(A)是一种新的抗精神分裂症药物,可由化合物B, C, D在有机溶剂中通过
以下两条路线合成得到。

(1)E的结构简式为 ,其含氧官能团有 (写名称)o
(2)由C, D生成化合物F的反应类型是 。化合物C与足量的NaOH乙醇溶液共热反应的产物的名称是
(3)H属于氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式: 、
(4)合成F(相对分子质量为366)时还可能生成一种相对分子质量为285的副产物G,G能使漠水褪色,G的结构简式为
(5)已知: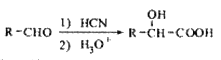 写出由C制备化合物
写出由C制备化合物 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
【答案】(1)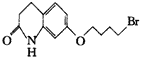 肽键、醚键
肽键、醚键
(2)取代反应 1,3–丁二烯
(3) ![]()
![]()
(4)
(5)
【解析】
试题分析:(1)线路一是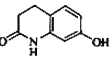 和
和![]() 发生取代反应,生成
发生取代反应,生成 和溴化氢,其中的含氧官能团是肽键、醚键。
和溴化氢,其中的含氧官能团是肽键、醚键。
(2)路线二是![]() 先和
先和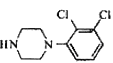 氨基上的氢取代,在与
氨基上的氢取代,在与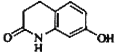 取代生成
取代生成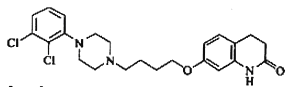 ,化合物C与足量的NaOH乙醇溶液共热发生消去反应,生成2个双键的1,3–丁二烯。
,化合物C与足量的NaOH乙醇溶液共热发生消去反应,生成2个双键的1,3–丁二烯。
(3)H属于氨基酸, H能与FeCl3溶液发生显色反应,说明结构中有酚羟基,且苯环上的一氯代物只有2种取代基在苯环的对位上,与B的水解产物互为同分异构体,故结构为![]() 和
和![]() 。
。
(4)合成F(相对分子质量为366)时还可能生成一种相对分子质量为285的副产物G,,G比F少81,G能使漠水褪色,说明有双键,故G比F少了一个溴和一个氢,发生了消去反应,故G的结构简式为 。
。
(5)由C制备化合物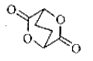 的合成路线流程图为:
的合成路线流程图为: 。
。


科目:高中化学 来源: 题型:
【题目】在15g铁和氧化铁的混合物中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
(1)混合物中铁的质量为 g
(2)稀H2SO4的物质的量浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的 ΔH>0
2AB3(g)”的 ΔH>0
B. 图②表示压强对可逆反应 2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医疗上绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
Ⅰ.【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备 FeSO4 7H2O晶体,步骤如下:

(1)预处理:先将废铁屑加入到饱和 Na2CO3溶液中洗涤,目的是__________ ,然后将废铁屑用水洗涤 2~3 遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2
(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为__________ 。实验室常用铁氰化钾溶液检验反应生成的Fe2+,写出该反应的离子反应方程式:______________;
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,冷却结晶,滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
Ⅱ.【测定FeSO4 7H2O 含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,准确量取 25.00mL 该液体于锥形瓶中,用 0.1000mol/L KMnO4标准溶液滴定滴定3次,平均消耗 10.00mL标准液,该样品中 FeSO4 7H2O 的质量分数为________ 。(已知 Mr(FeSO4 7H2O)=278)。
(2)若测量结果偏小,则可能是在定容时________(填“俯视”或“仰视”)读数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】(Ⅰ)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) ![]() 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中右图所示。以下说法正确的是 。
① a1>a2 ②b1<b2 ③ t1>t2 ④ 右图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点X的浓度:A>C



(Ⅱ)在容积可变的密闭容器中发生反应:mA(g) + nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左 向右,不);
(2)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(3)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据及装置示意图如下:3![]() +8HNO3—→3
+8HNO3—→3![]() +8NO↑+7H2O
+8NO↑+7H2O

实验步骤如下:

Ⅰ.在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重。
请回答下列问题:
(1)装置b的名称为 ,使用时要从 (填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是
(2)本实验所用50%的硝酸的物质的量浓度为 ;实验中,氮氧化物废
气(主要成分为N02和NO)可以用NaOH溶液来吸收,其主要反应为:
2N02+2NaOH=NaN02+NaN03+H20和NO+N02+2NaOH=2NaN02+H20
其中NaOH溶液可以用Na2C03溶液来替代,请模仿上述反应,写出Na2C03溶液吸收的两个方程式:
;
(3)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是 。
(4)为了除去可能的杂质和减少产品损失,可分别用 和 洗涤晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请将括号中的杂质去除,依次写出除杂试剂和实验方法
例:CO2(HCl):饱和NaHCO3溶液,洗气。
①甲烷(乙烯):___________________,________。
②水(碘):___________________,________。
③HBr(Br2):___________________,________。
④溴苯(Br2):___________________,________。
⑤乙醇(乙酸):___________________,________。
⑥乙酸乙酯(乙酸):___________________,________。
Ⅱ.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关信息如下:
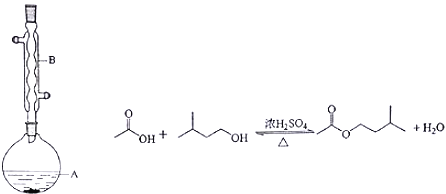
相对分子质量 | 沸点/℃ | 水中溶解度 | |
异戊醇 | 88 | 131 | 微溶 |
乙酸 | 60 | 118 | 溶 |
乙酸异戊酯 | 130 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是________________;
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层_________(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(3)本实验中加入过量乙酸的目的是_________________;
(4)实验中加入少量无水硫酸镁的目的是_________________;
(5)本实验的产率是____________。
A.30% B.40% C.50% D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g。再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是 W1 g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。有同学提出,还可以采用以下方法来测定:
①溶解样品改用了硫酸,而不用盐酸,为什么 。

②选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
③若滴定用掉c mol/ L KMnO4溶液bmL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯结构简式如图所示。下列有关柠檬烯的分析正确的是( )

A. 它的一氯代物有6种
B. 它的分子中所有的碳原子一定在同一平面上
C. 它和丁基苯(![]() )互为同分异构体
)互为同分异构体
D. 一定条件下,它分别可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com