
ЁОЬтФПЁПЁОМгЪдЬтЁПЃЈЂёЃЉдквЛИіШнЛ§ЙЬЖЈВЛБфЕФУмБеШнЦїжаНјааЗДгІЃК2X(g) + Y(g) ![]() 2Z(g) ЃЌвбжЊНЋ2molXКЭ1molYГфШыИУШнЦїжаЃЌЗДгІдкОјШШЬѕМўЯТДяЕНЦНКтЪБЃЌZЕФЮяжЪЕФСПЮЊpmolЁЃЛиД№ЯТСаЮЪЬт
2Z(g) ЃЌвбжЊНЋ2molXКЭ1molYГфШыИУШнЦїжаЃЌЗДгІдкОјШШЬѕМўЯТДяЕНЦНКтЪБЃЌZЕФЮяжЪЕФСПЮЊpmolЁЃЛиД№ЯТСаЮЪЬт
ЃЈ1ЃЉИУЗДгІЕФv-tЭМЯёШчЭМжазѓЭМЫљЪОЁЃШєЦфЫћЬѕМўВЛБфЃЌНідкЗДгІЧАМгШыКЯЪЪЕФДпЛЏМСЃЌдђЦфv-tЭМЯёШчЭМжагвЭМЫљЪОЁЃвдЯТЫЕЗЈе§ШЗЕФЪЧ ЁЃ
Ђй a1ЃОa2 Ђкb1ЃМb2 Ђл t1ЃОt2 Ђм гвЭМжавѕгАВПЗжУцЛ§ИќДѓ ЂнСНЭМжавѕгАВПЗжУцЛ§ЯрЕШ
ЃЈ2ЃЉШєИУЗДгІдкШнЛ§ПЩБфЕФУмБеШнЦїжаЗЂЩњЃЌдкЮТЖШЮЊT1ЁЂT2ЪБЃЈе§ЗДгІЗХШШЃЉЃЌЦНКтЬхЯЕжаXЕФЬхЛ§ЗжЪ§ЫцбЙЧПБфЛЏЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ ЁЃ
AЃЎAЁЂCСНЕуЕФЗДгІЫйТЪЃКAЃОC
BЃЎAЁЂCСНЕуЕФЦјЬхУмЖШЃКAЃМC
CЃЎBЁЂCСНЕуЕФЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПЃКBЃМC
DЃЎгЩзДЬЌBЕНзДЬЌAЃЌПЩвдгУМгШШЕФЗНЗЈ
EЃЎAЁЂCСНЕуXЕФХЈЖШЃКAЃОC



ЃЈЂђЃЉдкШнЛ§ПЩБфЕФУмБеШнЦїжаЗЂЩњЗДгІЃКmA(g) + nB(g)![]() pC(g)ЃЌдквЛЖЈЮТЖШКЭВЛЭЌбЙЧПЯТДяЕНЦНКтЪБЃЌЗжБ№ЕУЕНAЕФЮяжЪЕФСПХЈЖШШчЯТБэ
pC(g)ЃЌдквЛЖЈЮТЖШКЭВЛЭЌбЙЧПЯТДяЕНЦНКтЪБЃЌЗжБ№ЕУЕНAЕФЮяжЪЕФСПХЈЖШШчЯТБэ
бЙЧПp/Pa | 2ЁС105 | 5ЁС105 | 1ЁС106 |
c(A)/molЁЄL-1 | 0.08 | 0.20 | 0.44 |
ЃЈ1ЃЉЕБбЙЧПДг2ЁС105 PaдіМгЕН5ЁС105 PaЪБЃЌЦНКт вЦЖЏЃЈЬюЃКЯђзѓ ЯђгвЃЌВЛЃЉЃЛ
ЃЈ2ЃЉЕБбЙЧПЮЊ1ЁС106 PaЪБЃЌДЫЗДгІЕФЦНКтГЃЪ§БэДяЪНЃК ЁЃ
ЃЈ3ЃЉЦфЫћЬѕМўЯрЭЌЪБЃЌдкЩЯЪіШ§ИібЙЧПЯТЗжБ№ЗЂЩњИУЗДгІЁЃ2ЁС105 PaЪБЃЌAЕФзЊЛЏТЪЫцЪБМфБфЛЏШчЯТЭМЃЌЧыдкЭМжаВЙГфЛГібЙЧПЗжБ№ЮЊ5ЁС105 Pa КЭ1ЁС106 PaЪБЃЌAЕФзЊЛЏТЪЫцЪБМфЕФБфЛЏЧњЯпЃЈЧыдкЭМЯпЩЯБъГібЙЧПЃЉЁЃ
ЁОД№АИЁПЃЈЂёЃЉЃЈ1ЃЉЂкЂлЂнЃЈ2ЃЉB DЃЈЂђЃЉЃЈ1ЃЉВЛЃЈ2ЃЉ![]()
ЃЈ3ЃЉ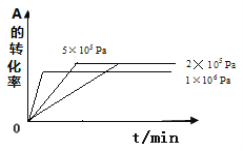
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈЂёЃЉЃЈ1ЃЉДпЛЏМСжЛФмИФБфЗДгІЫйТЪЃЌЕЋВЛФмИФБфЦНКтзДЬЌЃЌЫљвдЪЙгУДпЛЏМСКѓb1ЃМb2ЁЂt1ЃОt2ЁЂСНЭМжавѕгАВПЗжУцЛ§ЯрЕШЃЌД№АИбЁЂкЂлЂнЁЃ
ЃЈ2ЃЉAЁЂИљОнЭМЯёПЩжЊCЕубЙЧПДѓгкAЕубЙЧПЃЌЫљвдAЁЂCСНЕуЕФЗДгІЫйТЪЃКAЃМCЃЌAДэЮѓЃЛBЁЂИљОнЭМЯёПЩжЊCЕубЙЧПДѓгкAЕубЙЧПЃЌдђCЕуШнЛ§аЁгкAЕуШнЛ§ЃЌЦјЬхЕФжЪСПВЛБфЃЌдђAЁЂCСНЕуЕФЦјЬхУмЖШЃКAЃМCЃЌBе§ШЗЃЛCЁЂИљОнЭМЯёПЩжЊBКЭCСНЕуXЕФЬхЛ§ЗжЪ§ЯрЕШЃЌдђЛьКЯЦјЬхЕФЮяжЪЕФСПЯрЕШЃЌЫљвдЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПЯрЕШЃЌCДэЮѓЃЌDЁЂгЩзДЬЌBЕНзДЬЌAЃЌXЕФЬхЛ§ЗжЪ§діДѓЃЌЗДгІгІИУЯђФцЗДгІЗНЯђНјааЁЃе§ЗНгІЪЧЗХШШЗДгІЃЌвђДЫПЩвдгУМгШШЕФЗНЗЈЃЌDе§ШЗЃЛE.ИљОнЭМЯёПЩжЊCЕубЙЧПДѓгкAЕубЙЧПЃЌдђCЕуШнЛ§аЁгкAЕуШнЛ§ЃЌдђИљОнРеЯФЬиСадРэПЩжЊAЁЂCСНЕуXЕФХЈЖШЃКAЃМCЃЌEДэЮѓЃЌД№АИбЁBDЁЃД№АИбЁBDЁЃ
ЃЈЂђЃЉЃЈ1ЃЉЕБбЙЧПДг2ЁС105PaдіМгЕН5ЁС105 PaЪБЃЌAЕФХЈЖШЪЧдРДЕФ2.5БЖЃЌвђДЫЦНКтВЛвЦЖЏЁЃ
ЃЈ2ЃЉЕБбЙЧПЮЊ1ЁС106 PaЪБЃЌAЕФХЈЖШДѓгк5ЁС105ЪБЕФ2БЖЛЙЖрЃЌетЫЕУїЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌвђДЫДЫЪБBВЛЪЧЦјЬЌЃЌдђДЫЗДгІЕФЦНКтГЃЪ§БэДяЪНKЃН![]() ЁЃ
ЁЃ
ЃЈ3ЃЉИљОнвдЩЯЗжЮіПЩжЊбЙЧПЗжБ№ЮЊ5ЁС105 Pa КЭ1ЁС106 PaЪБЃЌЗДгІЫйТЪОљЪЧдіДѓЕФЃЌМДЕНДяЦНКтЕФЪБМфМѕЩйЃЌЕЋЧАепзЊЛЏТЪВЛБфЃЌЖјКѓепзЊЛЏТЪНЕЕЭЃЌдђAЕФзЊЛЏТЪЫцЪБМфЕФБфЛЏЧњЯпЮЊ ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП[ЛЏбЇвЛбЁао5ЃКгаЛњЛЏбЇЛљДЁ]СхРМШЉОпгаЬ№ШѓЕФАйКЯЯуЮЖЃЌЖдЦЄЗєЕФДЬМЄадаЁЃЌЖдМюЮШЖЈЃЌЙуЗКгУгкАйКЯЁЂЖЁЯуЁЂгёРМЁЂВшЛЈвдМАЫиаФРМЁЂЖЋЗНаЭЯуаЭШегУЯуОЋЕФКЯГЩЁЃГЃгУзїЗЪдэЁЂЯДЕгМСЕФЯуСЯЃЌЛЙПЩгУзїЛЈЯуаЭЛЏзБЦЗЕФЯуСЯЁЃЦфКЯГЩТЗЯпШчЯТЭМЫљЪОЃК

ЃЈ1ЃЉBжаЙйФмЭХЕФУћГЦЪЧ ЃЛ
ЃЈ2ЃЉЂмЕФЗДгІРраЭЪЧ ЃЛ
ЃЈ3ЃЉаДГіЗДгІЂкЕФЛЏбЇЗНГЬЪН ЃЛ
ЃЈ4ЃЉЮкТхЭаЦЗЕФНсЙЙЪНШчЭМЫљЪОЃЌЦфЖўТШШЁДњЮяга жжЃЛ

НЋМзШЉЕФЫЎШмвКгыАБЫЎЛьКЯеєЗЂПЩжЦЕУЮкТхЭаЦЗЃЌИУЗДгІЕФЛЏбЇЗНГЬЪН ЃЛ
ЃЈ5ЃЉаДГіТњзуЯТСаЬѕМўЕФAЕФЭЌЗжвьЙЙЬх
ЂёЃЎгаСНИіШЁДњЛљЃЛ ЂђЃЎШЁДњЛљдкСкЮЛЁЃ
ЃЈ6ЃЉвбжЊЃК![]() ЁЃЗТееЩЯЪіСїГЬЃЌаДГівдCH3CH2CHOЮЊдСЯжЦБИОлШщЫс
ЁЃЗТееЩЯЪіСїГЬЃЌаДГівдCH3CH2CHOЮЊдСЯжЦБИОлШщЫс ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСПЩвдШЮбЁЃЉЃК
ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСПЩвдШЮбЁЃЉЃК
CH3CH2CHOЁњ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕЊЁЂСђЕФЛЏКЯЮягыШЫРрЩњЛюКЭЩњВњгазХУмЧаЕФСЊЯЕЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдкПеЦјжЪСПБЈИцЕФИїЯюжИБъжаЃЌгаSO2КЭNO2ЕФжИЪ§ЃЌSO2ЪЧвЛжжЮоЩЋгаЖОЦјЬхЃЌNO2ЪЧвЛжж (ЬюЁАЮоЩЋЁБЛђЁАКьзиЩЋЁБ)гаЖОЦјЬхЃЛ
ЃЈ2ЃЉАБЦјМЋвзШмгкЫЎЃЌЦфЫЎШмвКЯд (ЬюЁАЫсЁБЁЂЁАМюЁБЛђЁАжаЁБ)адЃЛ
ЃЈ3ЃЉМгШШЪБЃЌХЈСђЫсПЩгыЬМЗЂЩњЗДгІЃКC+2H2SO4(ХЈ)![]() CO2Ёќ+2SO2Ёќ+2H2OЁЃдкИУЗДгІжаЃЌХЈH2SO4БэЯжГі (ЬюЁАЮќЫЎЁБЁЂЁАЭбЫЎЁБЛђЁАбѕЛЏЁБ)адЁЃ
CO2Ёќ+2SO2Ёќ+2H2OЁЃдкИУЗДгІжаЃЌХЈH2SO4БэЯжГі (ЬюЁАЮќЫЎЁБЁЂЁАЭбЫЎЁБЛђЁАбѕЛЏЁБ)адЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩКЯГЩЦјжЦБИввДМвЛАугаСНжжЗНЗЈЃК
ЃЈ1ЃЉжБНгКЯГЩЗЈЂй2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) ЁїH1
CH3CH2OH(g) + 3H2O(g) ЁїH1
Ђк2CO(g) +4H2(g) ![]() CH3CH2OH(g) +H2O(g) ЁїH2= -253.6kJЁЄmol-1
CH3CH2OH(g) +H2O(g) ЁїH2= -253.6kJЁЄmol-1
ЃЈ2ЃЉМфНгКЯГЩЗЈ
КЯГЩЦјЗДгІЩњГЩЖўМзУбЃЈCH3OCH3ЃЉЃЌЖўМзУбєЪЛљЛЏКЯЩњГЩввЫсМзѕЅЃЌввЫсМзѕЅМгЧтЕУЕНввДМЁЃЦфЩњВњСїГЬШчЯТЭМЫљЪОЃК
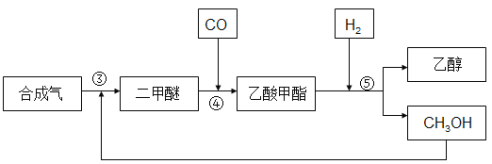
Ђл 3CO(g) + 3H2(g) ![]() CH3OCH3(g) + CO2 ЁїH3= -260.2kJЁЄmol-1
CH3OCH3(g) + CO2 ЁїH3= -260.2kJЁЄmol-1
Ђм CH3OCH3(g) + CO(g) ![]() CH3COOCH3(g)
CH3COOCH3(g)
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдк5MPaЁЂЦ№ЪМЭЖСЯСПn(H2):n(CO2)=3ЃК1ЪБЃЌВтЕУВЛЭЌЮТЖШЪБЗДгІЂйжаИїЮяжЪЕФЦНКтзщГЩШчЭМ1ЫљЪОЃК
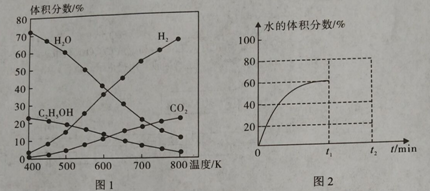
ЂйЗДгІЂйЕФЁїH1 0ЃЌЁїS 0ЁЃЃЈЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБЃЉ
ЂквбжЊCO(g) + H2O(g) ![]() CO2(g) + H2(g) ЁїH= -41 kJЁЄmol-1ЃЌдђЁїH1= ЁЃ
CO2(g) + H2(g) ЁїH= -41 kJЁЄmol-1ЃЌдђЁїH1= ЁЃ
Ђл500KЪБЃЌЗДгІДяЕНЦНКтКѓЃЌдкt1minЪБЩ§ЮТЕН600KЃЌЗДгІдкt2minжиаТДяЕНЦНКтЃЌЧыдкЭМ2жаЛГіЬхЯЕжаЫЎЕФЬхЛ§ЗжЪ§дкt1minКѓЕФБфЛЏЧњЯпЁЃ
ЃЈ2ЃЉЖдЗДгІЂлДІгкЛЏбЇЦНКтзДЬЌЪБЕФУшЪіЃЌе§ШЗЕФЪЧ ЁЃЃЈЬюзжФИЃЉЁЃ
AЃЎCOЕФКЌСПБЃГжВЛБф BЃЎШнЦїжаCH3OCH3ХЈЖШгыCO2ХЈЖШЯрЕШ
CЃЎ3Vе§ЃЈCOЃЉ=Vе§(CH3OCH3) DЃЎЬхЯЕЕФЮТЖШБЃГжВЛБф
ЃЈ3ЃЉМфНгКЯГЩЗЈжаНЋМзДМЃЈCH3OHЃЉбЛЗЪЙгУЕФФПЕФЪЧ ЁЃ
ЃЈ4ЃЉдк2MpaЁЂTЁцЪБ1LЕФКуШнШнЦїжаЃЌГфШы1.0molввЫсМзѕЅКЭ2.0molЧтЦјЃЌЗЂЩњЗДгІЂнЃЌОt minКѓЗДгІДяЕНЦНКтЃЌВтЕУввЫсМзѕЅЕФзЊЛЏТЪЮЊ75%ЁЃдђЧтЦјЕФЗДгІЫйТЪv(H2)= ЃЌЦНКтГЃЪ§K= ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдЊЫижмЦкБэЪЧбЇЯАЛЏбЇЕФживЊЙЄОпЃЌЫќвўКЌзХаэЖраХЯЂКЭЙцТЩЁЃЯТУцЪЧАЫжжЖЬжмЦкдЊЫиЕФЯрЙиаХЯЂЃЈвбжЊюыЕФдзгАыОЖЮЊ0.089 nmЃЉ
дЊЫиДњКХ | A | B | C | D | E |
дзгАыОЖ/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
жївЊЛЏКЯМл | +2 | +3 | +6ЃЌЃ2 | Ѓ1 | Ѓ2 |
FдзгжаЮожазгЃЌGзюИпе§МлЪ§гыИКМлЪ§ЯрЕШЃЌЧвзюЭтВуЕчзгЪ§ЪЧДЮЭтВуЕФЖўБЖЃЌHдЊЫиЕЅжЪбцЩЋЗДгІГЪЛЦЩЋЁЃ
ЃЈ1ЃЉCдЊЫидкдЊЫижмЦкБэжаЕФЮЛжУ ЁЃBаЮГЩЕФМђЕЅРызгЕФНсЙЙЪОвтЭМ ЁЃ
ЃЈ2ЃЉЩЯЪіАЫжждЊЫиЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяжаЫсадзюЧПЕФЪЧ ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ3ЃЉгУЕчзгЪНБэЪОAЁЂDаЮГЩЛЏКЯЮяЕФЙ§ГЬЃК ЁЃ
ЃЈ4ЃЉHЁЂEаЮГЩдзгИіЪ§БШЮЊ1ЁУ1ЕФЛЏКЯЮяжаЫљКЌЛЏбЇМќРраЭЮЊ ЁЃ
ЃЈ5ЃЉGE2ЕФЕчзгЪНЮЊ ЃЌFгыGаЮГЩЕФзюМђЕЅЕФЛЏКЯЮяЕФНсЙЙЪНЮЊ ЁЃ
ЃЈ6ЃЉEЕФЧтЛЏЮяБШCЕФЧтЛЏЮяЕФШлЗаЕуИпЕФдвђЪЧ ЁЃ
ЃЈ7ЃЉAЁЂBЁЂCЁЂEдзгАыОЖгЩДѓЕНаЁЕФЫГађЮЊ(гУдЊЫиЗћКХБэЪО) ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁОЛЏбЇЁЊбЁао5ЃКгаЛњЛЏбЇЛљДЁЁП
АЂСЂпЩБн(A)ЪЧвЛжжаТЕФПЙОЋЩёЗжСбжЂвЉЮяЃЌПЩгЩЛЏКЯЮяB, C, DдкгаЛњШмМСжаЭЈЙ§
вдЯТСНЬѕТЗЯпКЯГЩЕУЕНЁЃ

ЃЈ1ЃЉEЕФНсЙЙМђЪНЮЊ ЃЌЦфКЌбѕЙйФмЭХга ЃЈаДУћГЦ)o
ЃЈ2ЃЉгЩC, DЩњГЩЛЏКЯЮяFЕФЗДгІРраЭЪЧ ЁЃЛЏКЯЮяCгызуСПЕФNaOHввДМШмвКЙВШШЗДгІЕФВњЮяЕФУћГЦЪЧ
ЃЈ3ЃЉHЪєгкАБЛљЫсЃЌгыBЕФЫЎНтВњЮяЛЅЮЊЭЌЗжвьЙЙЬхЁЃHФмгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЃЌЧвБНЛЗЩЯЕФвЛТШДњЮяжЛга2жжЁЃаДГіСНжжТњзуЩЯЪіЬѕМўЕФHЕФНсЙЙМђЪНЃК ЁЂ
ЃЈ4ЃЉКЯГЩFЃЈЯрЖдЗжзгжЪСПЮЊ366ЃЉЪБЛЙПЩФмЩњГЩвЛжжЯрЖдЗжзгжЪСПЮЊ285ЕФИБВњЮяGЃЌGФмЪЙФЎЫЎЭЪЩЋЃЌGЕФНсЙЙМђЪНЮЊ
ЃЈ5ЃЉвбжЊЃК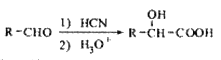 аДГігЩCжЦБИЛЏКЯЮя
аДГігЩCжЦБИЛЏКЯЮя ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮбЁЃЉЁЃКЯГЩТЗЯпСїГЬЭМЪОР§ШчЯТЃК
ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮбЁЃЉЁЃКЯГЩТЗЯпСїГЬЭМЪОР§ШчЯТЃК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУШэУЬПѓЃЈжївЊГЩЗжЮЊMnO2ЃЉЩњВњИпУЬЫсМиВњЩњЕФУЬФржаЃЌЛЙКЌга18ЃЅЕФMnO2ЁЂ3ЃЅЕФKOHЃЈОљЮЊжЪСПЗжЪ§ЃЉЃЌМАЩйСПCuЁЂPbЕФЛЏКЯЮяЕШЃЌгУУЬФрПЩЛиЪежЦШЁMnCO3ЃЌЙ§ГЬШчЭМЃК

ЃЈ1ЃЉИпУЬЫсМиЕФбѕЛЏадЧПШѕгыШмвКЕФЫсМюадгаЙиЃЌдкЫсадЬѕМўЯТЦфбѕЛЏадНЯЧПЁЃЭЈГЃгУРДЫсЛЏИпУЬЫсМиЕФЫсЪЧ
ЃЈ2ЃЉГ§ШЅТЫвК1жаCu2ЃЋЕФРызгЗНГЬЪНЪЧ
ЃЈ3ЃЉОЪЕбщжЄУїЃКMnO2ЩдЙ§СПЪБЃЌЦ№ЪМH2SO4ЁЂFeSO4ЛьКЯШмвКжаcЃЈHЃЋЃЉЃЏ![]() <0.7ЪБЃЌТЫвК1жаФмЙЛМьбщГігаFe
<0.7ЪБЃЌТЫвК1жаФмЙЛМьбщГігаFe![]() ЃЛ
ЃЛ![]() Ён0.7ЪБЃЌТЫвК1жаВЛФмМьбщГігаFe2ЃЋЁЃИљОнЩЯЪіаХЯЂЛиД№ЂйЂкЂлЃК
Ён0.7ЪБЃЌТЫвК1жаВЛФмМьбщГігаFe2ЃЋЁЃИљОнЩЯЪіаХЯЂЛиД№ЂйЂкЂлЃК
ЂйМьбщFe2ЃЋЪЧЗёбѕЛЏЭъШЋЕФЪЕбщВйзїЪЧ__________ЁЃ
ЂкЩњВњЪБH2SO4ЁЂFeSO4ЛьКЯШмвКжаcЃЈHЃЋЃЉЃЏcЃЈFe2ЃЋЃЉПижЦдк0.7ЁЋ1жЎМфЃЌВЛвЫЙ§ДѓЃЌЧыДгНкдМвЉЦЗЕФНЧЖШЗжЮіЃЌдвђЪЧ__________ЁЃ
ЂлШєcЃЈHЃЋЃЉЃЏcЃЈFe2ЃЋЃЉ>1ЃЌЕїНкcЃЈHЃЋЃЉЃЏcЃЈFe2ЃЋЃЉЕН0.7ЁЋ1ЕФзюРэЯыЪдМСЪЧЃпЃЈЬюађКХЃЉ
aЃЎNaOHШмвК BЃЎЬњЗл cЃЎMnOЁЃ
ЃЈ4ЃЉаДГіТЫвК2жаМгШыЙ§СПNH4HCO3ЗДгІЕФРызгЗНГЬЪН__________ЁЃ
ЃЈ5ЃЉЩЯЪіЙ§ГЬУЬЛиЪеТЪПЩДя95ЃЅЃЌШєДІРэ1740 kgЕФУЬФрЃЌПЩЩњВњMnCO3__________kgЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП[бЁао3ЁЊЮяжЪНсЙЙгыаджЪ]ЂёФГдЊЫиXКЫЕчКЩЪ§аЁгк18ЃЌЦфдзгЕФЕчзгВуЪ§ЮЊnЃЌзюЭтВуЕчзгЪ§ЮЊ2n+1ЃЌдзгКЫФкжЪзгЪ§ЪЧ2n2-1ЁЃЯТСагаЙиXЕФЫЕЗЈжаЃЌВЛе§ШЗЕФЪЧ
AЃЎX ФмаЮГЩЛЏбЇЪНЮЊX(OH)3ЕФМю
BЃЎX ВЛФмаЮГЩЛЏбЇЪНЮЊNaXO3ЕФКЌбѕЫсФЦбЮ
CЃЎX дзгЕФзюЭтВуЕчзгЪ§КЭКЫЕчКЩЪ§ВЛПЩФмЮЊХМЪ§
DЃЎX ФмгыФГаЉН№ЪєдЊЫиЛђЗЧН№ЪєдЊЫиаЮГЩЛЏКЯЮя
ЂђвбжЊ AЁЂBЁЂCЁЂDЁЂE ЖМЪЧдЊЫижмЦкБэжадзгађЪ§аЁгк36ЕФдЊЫиЃЌЧвЫќУЧЕФКЫЕчКЩЪ§вРДЮдіДѓЁЃBдзгЕФpЙьЕРАыГфТњЃЌаЮГЩЕФЧтЛЏЮяЕФЗаЕуЪЧЭЌжїзхдЊЫиЕФЧтЛЏЮяжазюЕЭЕФЁЃDдзгЕУЕНвЛИіЕчзгКѓ 3p ЙьЕРШЋГфТњЁЃA+БШDдзгаЮГЩЕФРызгЩйвЛИіЕчзгВуЁЃCгыAаЮГЩA2CаЭРызгЛЏКЯЮяЁЃEЕФдзгађЪ§ЮЊ26ЃЌEдзгЛђРызгЭтЮЇгаНЯЖрФмСПЯрНќЕФПеЙьЕРЖјФмгывЛаЉЗжзгЛђРызгаЮГЩХфКЯЮяЁЃ ЧыИљОнвдЩЯЧщПіЃЌЛиД№ЯТСаЮЪЬтЃК
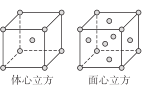
ЃЈ1ЃЉEдЊЫидзгЕФКЫЭтЕчзгХХВМЪНЪЧ ЁЃ
ЃЈ2ЃЉAЁЂBЁЂCЁЂDЕФЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЮЊ ЁЃ (гУдЊЫиЗћКХБэЪО)
ЃЈ3ЃЉB дЊЫиЕФЧтЛЏЮяЕФЗаЕуЪЧЭЌжїзхдЊЫиЕФЧтЛЏЮяжазюЕЭЕФдвђЪЧ ЁЃ
ЃЈ4ЃЉЛЏКЯЮяBD3ЕФЗжзгжаЃЌдзгBЕФдгЛЏЙьЕРЪЧ ЃЌЗжзгПеМфЙЙаЭЪЧ ЁЃ
ЃЈ5ЃЉE ЕФвЛжжГЃМћХфКЯЮяE(CO)5ГЃЮТЯТГЪвКЬЌЃЌШлЕуЮЊ-20.5ЁцЃЌЗаЕуЮЊ103ЁцЃЌвзШмгкЗЧМЋадШмМСЁЃ ОнДЫПЩХаЖЯE(CO)5ЕФОЇЬхРраЭЮЊ ЁЃН№Ъє E ЕЅжЪЕФОЇЬхдкВЛЭЌЮТЖШЯТгаСНжжЖбЛ§ЗНЪНЃЌОЇАћЗжБ№ШчЭМЫљЪОЁЃЬхаФСЂЗНОЇАћКЭУцаФСЂЗНОЇАћжаЪЕМЪКЌгаЕФEдзгИіЪ§жЎБШЮЊ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвРОнбѕЛЏЛЙдЗДгІЃК2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)ЩшМЦЕФдЕчГиШчЭМЫљЪОЁЃЧыЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉЕчМЋXЕФВФСЯЪЧ______ ЃЛЕчМЋYВФСЯЪЧ__________ ЁЃ
ЃЈ2ЃЉвјЕчМЋЩЯЗЂЩњЕФЕчМЋЗДгІЮЊ____________ЃЛXЕчМЋЩЯЗЂЩњЕФЕчМЋЗДгІЮЊ____________ЁЃ
ЃЈ3ЃЉЭтЕчТЗжаЕФЕчзгЪЧДг______ЕчМЋСїЯђ______ЕчМЋЁЃЃЈЬюЁАXЁБЛђЁАYЁБЃЉ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com