
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色。
(1)C元素在元素周期表中的位置 。B形成的简单离子的结构示意图 。
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物中所含化学键类型为 。
(5)GE2的电子式为 ,F与G形成的最简单的化合物的结构式为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) 。
【答案】(1)第三周期 第ⅥA族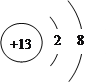
(2)HClO4
(3)![]()
(4)离子键、非极性键
(5)![]()
(6)H2O分子间存在氢键,H2S分子间不存在氢键
(7)Mg>Al>S>O
【解析】试题分析:F原子中无中子,所以是H,G最高正价数与负价数相等,是且最外层电子数是次外层的二倍,所以G是C,H元素单质焰色反应呈黄色,应为Na。原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,铍的原子半径为0.089nm,E的原子半径小于铍且其最低负价是-2,元素的最低负价=其最外层电子数-8,所以E位于第VIA族,为O元素,这几种元素都是短周期元素,原子半径大小顺序是A>B>C>D,这几种元素的原子半径都大于铍原子,则为第三周期元素,结合其主要化合价知,A是Mg元素、B是Al元素、C是S元素、D是Cl元素,则
(1)S元素在元素周期表中的位置第三周期 第ⅥA族。铝元素形成的简单离子的结构示意图为 。
。
(2)非金属性越强最高价氧化物水化物的酸性越强,则八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4。
(3)活泼金属和活泼非金属元素之间易形成离子键,A和D元素形成的化合物是离子化合物氯化镁,其形成过程为:![]() 。
。
(4)H、E形成原子个数比为1:1的化合物是过氧化钠,其电子式为![]() ,含有的化学键类型为离子键、非极性键。
,含有的化学键类型为离子键、非极性键。
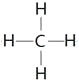
(5)GE2是二氧化碳,含有共价键的共价化合物,电子式为![]() ,F与G形成的最简单的化合物是甲烷,结构式为
,F与G形成的最简单的化合物是甲烷,结构式为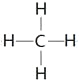 ;
;
(6)H2O分子间存在氢键,H2S分子间不存在氢键,所以E的氢化物比C的氢化物的熔沸点高。
(7)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O。


科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示a,b,c,d括号内数据表示坐标。
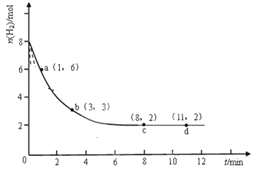
(1)0-a,a-b,b-c,c-d四段中,平均反应速率最大的时间段是 ,该时间段内H2的平均反应速率是 。
(2)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(3)平衡时CO2的转化率是 ;反应前后容器内的压强比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
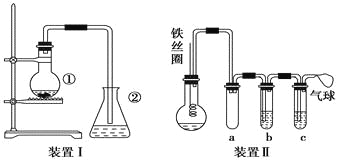
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置Ⅰ中①中的化学方程式为______________________________________。
②中离子方程式为_______________________________________。
(2)①中长导管的作用是__________________________。
(3)烧瓶中褐色油状液滴中有机物的成分是________,要想得到纯净的该产物,可用______ __洗涤。洗涤后分离粗产品应使用的仪器是____ ____。
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是_______________________________________。
b中的试剂是____________________________________。
比较两套装置,装置Ⅱ的主要优点是
_____________________________________________________________
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时, 涉及如下反应: 2NO(g) +Cl2(g) ![]() 2ClNO(g) ΔH< 0
2ClNO(g) ΔH< 0
写出该反应的平衡常数表达式 。
为研究不同条件对反应的影响,:在恒温条件下, 向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2, 10 min时反应达到平衡。测得10 min内v(ClNO) =7.5×10-3 mol·L-1·min-1, 则平衡后n(Cl2) = mol, NO的转化率α1= 。其他条件保持不变, 反应在恒压条件下进行, 平衡时NO的转化率α2 α1(填“>” “<” 或“=”), 平衡常数K (填“增大” “减小” 或“不变”) 。若要使K减小, 可采取的措施是 。
II. 实验室可用NaOH溶液吸收NO2, 反应为2NO2+2NaOH![]() NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1, CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是 。
a. 向溶液A中加适量水 b. 向溶液A中加适量NaOH
c. 向溶液B中加适量水 d. 向溶液B中加适量NaOH
III.(1)已知丙醛的燃烧热为![]() ,丙酮的燃烧热为
,丙酮的燃烧热为![]() ,试写出丙醛燃烧热的热化学方程式 。
,试写出丙醛燃烧热的热化学方程式 。
(2)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH) 2,装置如右下图所示,其中P端通入CO2。

①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A. X、Y两端都必须用铁作电极 B. 可以用NaOH溶液作为电解液
C. 阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- D. 白色沉淀只能在阳极上产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO2(g)![]() N2O4(g) △H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g) △H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
(1)a、b、c、d四个点中,化学反应处于平衡状态的是 点。
(2)25 min时,增加了 (填物质的化学式) mol。
(3)a、b、c、d四个点中所表示的反应体系中,气体颜色由深到浅的顺序是 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】(Ⅰ)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) ![]() 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中右图所示。以下说法正确的是 。
① a1>a2 ②b1<b2 ③ t1>t2 ④ 右图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点X的浓度:A>C



(Ⅱ)在容积可变的密闭容器中发生反应:mA(g) + nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左 向右,不);
(2)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(3)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】碳、氮在自然界中广泛存在。
(1)CH3COOH中C原子轨道杂化类型有;1molCH3COOH分子中含有![]() 键的数目为
键的数目为
(2)50号元素Sn在周期表中位置是 ;写出50号元素Sn的基态原子核外电子排布式
(3)锡和碳一样能生成四氯化物(SnC14),然而锡又不同于碳,配位数可超过4.SnC14两种可能立体结构分别是 和
(4)与H20互为等电子体的一种含有碳元素的阳离子为 (填化学式);H20
与CH3CH20H可以任意比例互溶,除因为它们都是极性分子外,还因为
(5)元素X的某价态离子X}+中所有电子正好充满K, L, M三个电子层,它与
N3一形成的晶体结构如图所示。

①该晶体的阳离子与阴离子个数比为
②该晶体中Xn十离子中n=
③晶体中每个N3一被 个等距离的Xn+离子包围。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TPE的两条合成路线(部分试剂及反应条件省略):

(1)A的名称是 ;试剂Y为 。
(2)B→C的反应类型为 ;B中官能团的名称是 ,
D中官能团的名称是 。
(3)E→F的化学方程式是 。
(4)W是D的同分异构体,具有下列结构特征:①属于萘(![]() )的一元取代物;
)的一元取代物;
②存在羟甲基(-CH2OH)。写出W所有可能的结构简式: 。
(5)下列叙述正确的是______。
a. B的酸性比苯酚强
b. D不能发生还原反应
c. E含有3种不同化学环境的氢
d. TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是 。
A.2mol/LNa2CO3溶液
B.品红溶液
C.0.5mol/L BaCl2溶液
D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数= (精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com