
【题目】【化学—选修3:物质结构与性质】碳、氮在自然界中广泛存在。
(1)CH3COOH中C原子轨道杂化类型有;1molCH3COOH分子中含有![]() 键的数目为
键的数目为
(2)50号元素Sn在周期表中位置是 ;写出50号元素Sn的基态原子核外电子排布式
(3)锡和碳一样能生成四氯化物(SnC14),然而锡又不同于碳,配位数可超过4.SnC14两种可能立体结构分别是 和
(4)与H20互为等电子体的一种含有碳元素的阳离子为 (填化学式);H20
与CH3CH20H可以任意比例互溶,除因为它们都是极性分子外,还因为
(5)元素X的某价态离子X}+中所有电子正好充满K, L, M三个电子层,它与
N3一形成的晶体结构如图所示。

①该晶体的阳离子与阴离子个数比为
②该晶体中Xn十离子中n=
③晶体中每个N3一被 个等距离的Xn+离子包围。
【答案】(1)sp3、sp2,7NA
(2)第五周期ⅣA [Kr]4d105s25P2或1s22s22p63s23p63d104s24p64d105s25P2
(3)正四面体结构 平面正方形结构
(4)CH5+H2O与CH3CH2OH之间可以形成氢键。
(5)① 3∶1 ② 1 ③ 6
【解析】试题分析:(1)第一个碳周围四个单键,是sp3杂化,第二个碳周围一个双键两个单键,故为sp2杂化,1个CH3COOH分子中有6个单键一个双键,故1molCH3COOH分子中有7NA个![]() 键。
键。
(2)50号元素Sn在周期表中位置是第五周期ⅣA,基态原子核外电子排布式[Kr]4d105s25P2或1s22s22p63s23p63d104s24p64d105s25P2。
(3)SnCl4分子价电子对数为(4+4)/2=4,形成了四条杂化轨道,杂化轨道空间构型为正四面体,且每条杂化轨道均与Cl形成共价键,其空间构型为正四面体,若配位数可超过4则为平面正方形。
(4)H20是10电子微粒,含有10电子的一种含有碳元素的阳离子为CH5+;H20与CH3CH20H可以任意比例互溶,除因为它们都是极性分子外,还因为H2O与CH3CH2OH之间可以形成氢键。
(5)①阴离子在顶点上,故为8×1/8=1,阳离子在边上,为12×1/4=3,故该晶体的阳离子与阴离子个数比为3:1;②比例式为X3N,N是-3价,故X是+1价,n=1;③据图像得晶体中每个N3一被6个等距离的Xn+离子包围。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如下图实验:

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O 4和SO2气体,实验后取d中溶液的1/10 置于锥形瓶中,用0.05mol/L 标准碘溶液进行滴定,消耗标准溶液 20mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是________________________。
(2)装置a和c的作用分别是_______和________(填标号,可以多选)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)滴定达终点时的现象是________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(5)通过计算可知,该黄铜矿的纯度为________________________。
乙同学在甲同学实验的基础上,设计了两种与甲不同的吸收方法,并对吸收产物进行有关处理,同样也测出了黄铜矿的纯度。
(6)方法一:用如下图装置替代上述实验装置 d,同样可以达到实验目的是______(填序号)。

(7)方法二:将原装置 d 中的试液改为Ba(OH)2,但测得的黄铜矿纯度却产生了+1%的误差,假设实验操作均正确,可能的原因主要有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置为______;UW2的电子式为______;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是______、______。
(2)U、V、W形成的10电子氢化物中,最稳定的是______(写化学式、下同);沸点最高的是______;结合H+能力最强的是(写化学式)______。
(3)Z3W4与稀盐酸反应的离子方程式为______。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为______,由此可知VW和YW2还原性较强的是(写化学式)______。
(5)已知YW2和Cl2均可使品红溶液褪色,现将一定量的YW2和Cl2通入品红溶液中:
①若品红不褪色,则品红溶液中所发生的化学方程式为______。
②若品红褪色,为证明YW2和Cl2谁过量,最简单的操作、现象、结论是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色。
(1)C元素在元素周期表中的位置 。B形成的简单离子的结构示意图 。
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物中所含化学键类型为 。
(5)GE2的电子式为 ,F与G形成的最简单的化合物的结构式为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是

A、电源的A极是负极
B、电解池中只有O2、Fe3+发生还原反应
C、阳极上发生电极反应:H2O —e-=·OH+ H+
D、消耗1molO2,可以产生4mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:

(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是
(2)除去滤液1中Cu2+的离子方程式是
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/![]() <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe![]() ;
;![]() ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
①检验Fe2+是否氧化完全的实验操作是__________。
②生产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请从节约药品的角度分析,原因是__________。
③若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想试剂是_(填序号)
a.NaOH溶液 B.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工 业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:


(1)几种盐的溶解度见上图。反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、________________、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是___________________。
(3)反应Ⅳ的化学方程式为_______________________。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为____________________。
(5)上图煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为_____________________。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:

(1)常温下含碳量最高的气态烃是________(填对应字母)。
(2)能够发生加成反应的烃有________(填数字)种。
(3)一卤代物种类最多的是________(填对应字母)。
(4)写出C与溴水反应的化学方程式:______________________。
(5)写出F发生溴代反应的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。达到平衡时NO的转化率为_______
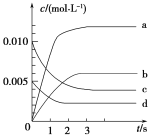
(2)能说明该反应已达到平衡状态的是________(填字母序号,下同)。
A.v (NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
A.增加容器体积 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com