
����Ŀ��U��V��W��X��Y��Z��ԭ������������������ֳ���Ԫ�أ�Y�ĵ�����W2��ȼ�յIJ����ʹƷ����Һ��ɫ��Z��WԪ���γɵĻ�����Z3W4���д��ԣ�U�ĵ�����W2��ȼ�տ�����UW��UW2�������塣X�ĵ�����һ�ֽ������ý�����UW2�о���ȼ�����ɺڡ������ֹ��塣
��ش��������⣺
��1��X�����ڱ��е�λ��Ϊ______��UW2�ĵ���ʽΪ______��X��UW2�о���ȼ�����ɵĺڡ������ֹ����л�ѧ������������______��______��
��2��U��V��W�γɵ�10�����⻯���У����ȶ�����______��д��ѧʽ����ͬ�����е���ߵ���______�����H+������ǿ���ǣ�д��ѧʽ��______��
��3��Z3W4��ϡ���ᷴӦ�����ӷ���ʽΪ______��
��4��YW2����ͨ��BaCl2��HNO3�Ļ����Һ�����ɰ�ɫ��������ɫ����VW���йط�Ӧ�����ӷ���ʽΪ______���ɴ˿�֪VW��YW2��ԭ�Խ�ǿ���ǣ�д��ѧʽ��______��
��5����֪YW2��Cl2����ʹƷ����Һ��ɫ���ֽ�һ������YW2��Cl2ͨ��Ʒ����Һ�У�
����Ʒ�첻��ɫ����Ʒ����Һ���������Ļ�ѧ����ʽΪ______��
����Ʒ����ɫ��Ϊ֤��YW2��Cl2˭��������IJ�������������______��
���𰸡���1����������IIA��![]() ���ۼ������Ӽ�
���ۼ������Ӽ�
��2��H2OH2ONH3
��3��Fe3O4+8H+��2Fe3++Fe2++4H2O
��4��3SO2+2NO3-+3Ba2++2H2O��3BaSO4��+2NO��+4H+SO2
��5����SO2+Cl2+2H2O��2HCl+H2SO4
������ɫ��Ʒ����Һ���ȣ��������SO2������������ɫ��Cl2����
�����������������Y�ĵ�����W2��ȼ�յIJ����ʹƷ����Һ��ɫ��������ΪSO2����YΪSԪ�أ�WΪOԪ�أ�Z��WԪ���γɵĻ�����Z3W4���д��ԣ���Z3W4ΪFe3O4��ZΪFeԪ�أ�U�ĵ�����W2��ȼ�տ�����UW��UW2�������壬Uԭ������С��OԪ�أ�ӦΪCO��CO2���壬UΪCԪ�أ�X�ĵ�����һ�ֽ������ý�����UW2�о���ȼ�����ɺڡ������ֹ��壬ӦΪMg��CO2�ķ�Ӧ����XΪMgԪ�أ�V��ԭ����������̼����֮�䣬��VΪNԪ�ء���
��1��XΪMg�������ڱ��е�λ��Ϊ���������� IIA�壬CO2�ǹ��ۻ��������ʽΪ![]() ��Mg��CO2�о���ȼ�����ɵĺڡ������ֹ���ֱ�Ϊ̼��MgO��̼�����к��й��ۼ���MgO�к������Ӽ���
��Mg��CO2�о���ȼ�����ɵĺڡ������ֹ���ֱ�Ϊ̼��MgO��̼�����к��й��ۼ���MgO�к������Ӽ���
��2��U��V��W�γɵ�10�����⻯��ֱ���CH4��NH3��H2O����Ԫ�طǽ�������ǿ��H2O���ȶ���NH3����֮�����������е�ȼ���ķе�ߣ�������ˮΪҺ�壬����������Ϊ���壬ˮ�ķе���ߣ�NH3Ϊ�������壬���H+������ǿ�������ᷴӦ��NH3+H3O+=NH4++H2O
��3��Fe3O4��ϡ���ᷴӦ�����ӷ���ʽΪFe3O4+8H+��2Fe3++Fe2++4H2O��
��4��SO2���л�ԭ�ԣ��������ᷢ��������ԭ��Ӧ������������ӣ������Ȼ����������ᱵ��������Ӧ�����ӷ���ʽΪ3SO2+2NO3-+3Ba2++2H2O��3BaSO4��+2NO��+4H+��������ԭ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�Ӧ�л�ԭ�ԣ�SO2��NO��
��5����֪YW2��Cl2����ʹƷ����Һ��ɫ���ֽ�һ������SO2��Cl2ͨ��Ʒ����Һ�У�
����Ʒ�첻��ɫ��˵����������������ǡ�÷�Ӧ����Ʒ����Һ���������Ļ�ѧ����ʽΪSO2+Cl2+2H2O��2HCl+H2SO4��
����Ʒ����ɫ��Ϊ֤��SO2��Cl2˭��������IJ������������ǣ�����ɫ��Ʒ����Һ���ȣ��������SO2������������ɫ��Cl2������


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������6.4g����������ȫȼ�գ�ֻ����8.8gCO2��7.2gH2O������˵����ȷ����
A���û��������̼��������Ԫ��
B���û�������̼����ԭ�Ӹ�����Ϊ1��4
C����ȷ���û������Ƿ�����Ԫ��
D���û�����һ����C2H8O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ������������壨FeSO4��7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʡ�ʵ�鲽�����£�

��1��ʵ�������Ѿ�ȷ��ȡ��Ũ��������500 mL 1 mol��L-1��������Һ��������ʱ�õ����������ձ����������⣬�������������� ��
��2������ڼ��������ˮ��������___________����Ӧ�����ӷ���ʽΪ ��
��3���������һϵ�в�������Ϊ ��ϴ�ӡ����ա���ȴ��������
��4����ʵ������ģ���ò�Ѫ������Ԫ�ص���������Ϊ ��
��5�����в����ᵼ�����ⶨ����Ԫ�غ���ƫ�ߵ���______��
A����������Ӱ�ˮ������ B�������ϴ�Ӳ���� C����������ղ����
��6��ijͬѧ���ֲ��ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1 mol��L-1��������Һ�����ˡ�ȡ��Һ�� ��Һ������Һ���______ɫ��˵���ò�Ѫ���ѱ��ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽���������ȡ����Ӧ��������ͼװ������������ʵ�飺
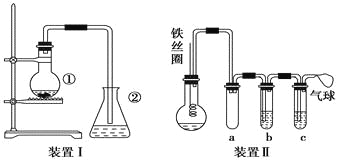
��һ�����ı����������ƿ�У�ͬʱ����������м��3��5 min���ֵ���AgNO3����ƿ����dz��ɫ�ij������ɣ���֤�������巢����ȡ����Ӧ��
��1��װ���������еĻ�ѧ����ʽΪ______________________________________��
�������ӷ���ʽΪ_______________________________________��
��2�����г����ܵ�������__________________________��
��3����ƿ�к�ɫ��״Һ�����л���ijɷ���________��Ҫ��õ������ĸò������______ __ϴ�ӡ�ϴ�Ӻ����ֲ�ƷӦʹ�õ�������____ ____��
��4����ͬѧ�����ͼ��ʾװ��������������ijЩ�Լ���ɸ�ʵ�顣��ѡ�õ��Լ��ǣ�����Һ�壻Ũ�������������Һ����������Һ�����Ȼ�̼��
a��������_______________________________________��
b�е��Լ���____________________________________��
�Ƚ�����װ�ã�װ��������Ҫ�ŵ���
_____________________________________________________________
_____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ݺ���FeCl3��FeCl2����Ļ���Ϊ�ⶨFeCl2�ĺ�������������ʵ�飺
����ȡ�������Ʒ������7.06g������Ʒ�ܽ�
�����ܽ�����Һ�У�����������˫��ˮ
��������������Һ�м���������NaOH��Һ���õ����ɫ����
�����������ˡ�ϴ�Ӻ������գ����������ټ��٣��õ���������4.00g
����ʵ��ش��������⣺
��1����Ʒ�ܽ�����������___________���Է�ֹ__________________��
��2��д���ܽ�����Һ��˫��ˮ��Ӧ�����ӷ���ʽ____________��
��3�����˲����г���©���⣬����Ҫ�IJ���������____________��
��4����������ʵ�鲽�����г����Ѿ�ϴ�Ӹɾ��ķ���____________��
��5��ͨ��ʵ���������ݣ����������Ʒ��FeCl2������������____________��
��6��ʵ���Ҳ�������װ����ȡ������ˮFeCl3���塣(��֪FeCl3�����׳��⣬���ּг���������ȥ��)

��װ�ô�������ȱ�ݣ��ò�����ˮFeCl3���壬����Ը�װ�ý��к����ĸĽ���____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�о����������������ڴ����к������ӵ������ʱ, �漰���·�Ӧ: 2NO(g) +Cl2(g) ![]() 2ClNO(g) ��H< 0
2ClNO(g) ��H< 0
д���÷�Ӧ��ƽ�ⳣ������ʽ ��
Ϊ�о���ͬ�����Է�Ӧ��Ӱ��,���ں���������, ��2 L�����ܱ������м���0.2 mol NO��0.1 mol Cl2, 10 minʱ��Ӧ�ﵽƽ�⡣���10 min��v(ClNO) =7.5��10-3 mol��L-1��min-1, ��ƽ���n(Cl2) = mol, NO��ת���ʦ�1= �������������ֲ���, ��Ӧ�ں�ѹ�����½���, ƽ��ʱNO��ת���ʦ�2 ��1(�>�� ��<�� ��=��), ƽ�ⳣ��K (����� ����С�� ���䡱) ����ҪʹK��С, �ɲ�ȡ�Ĵ�ʩ�� ��
II. ʵ���ҿ���NaOH��Һ����NO2, ��ӦΪ2NO2+2NaOH![]() NaNO3+NaNO2+H2O����0.2 mol NaOH��ˮ��Һ��0.2 mol NO2ǡ����ȫ��Ӧ��1 L��ҺA, ��ҺBΪ0.1 mol��L-1��CH3COONa��Һ, ������Һ��c(NO3-) ��c(NO2-) ��c(CH3COO-) �ɴ�С��˳��Ϊ ��
NaNO3+NaNO2+H2O����0.2 mol NaOH��ˮ��Һ��0.2 mol NO2ǡ����ȫ��Ӧ��1 L��ҺA, ��ҺBΪ0.1 mol��L-1��CH3COONa��Һ, ������Һ��c(NO3-) ��c(NO2-) ��c(CH3COO-) �ɴ�С��˳��Ϊ ��
(��֪HNO2�ĵ��볣��Ka=7.1��10-4 mol��L-1, CH3COOH�ĵ��볣��Ka=1.7��10-5 mol��L-1)
��ʹ��ҺA����ҺB��pH��ȵķ����� ��
a. ����ҺA�м�����ˮ b. ����ҺA�м�����NaOH
c. ����ҺB�м�����ˮ d. ����ҺB�м�����NaOH
III.��1����֪��ȩ��ȼ����Ϊ![]() ����ͪ��ȼ����Ϊ
����ͪ��ȼ����Ϊ![]() ����д����ȩȼ���ȵ��Ȼ�ѧ����ʽ ��
����д����ȩȼ���ȵ��Ȼ�ѧ����ʽ ��
��2����H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�Fe(OH) 2��װ��������ͼ��ʾ������P��ͨ��CO2��

��ʯīI�缫�ϵĵ缫��ӦʽΪ ��
��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��������˵������ȷ���� ������ţ���
A. X��Y���˶������������缫 B. ������NaOH��Һ��Ϊ���Һ
C. ���������ķ�Ӧ�ǣ�2H2O+ 2e��= H2��+ 2OH�� D. ��ɫ����ֻ���������ϲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2NO2(g)![]() N2O4(g) ��H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ��
N2O4(g) ��H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ��
��1��a��b��c��d�ĸ����У���ѧ��Ӧ����ƽ��״̬���� �㡣
��2��25 minʱ�������� �������ʵĻ�ѧʽ�� mol��
��3��a��b��c��d�ĸ���������ʾ�ķ�Ӧ��ϵ�У�������ɫ���dz��˳���� ������ĸ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��3:���ʽṹ�����ʡ�̼��������Ȼ���й㷺���ڡ�
��1��CH3COOH��Cԭ�ӹ���ӻ������У�1molCH3COOH�����к���![]() ������ĿΪ
������ĿΪ
��2��50��Ԫ��Sn�����ڱ���λ���� ��д��50��Ԫ��Sn�Ļ�̬ԭ�Ӻ�������Ų�ʽ
��3������̼һ�����������Ȼ��SnC14����Ȼ�����ֲ�ͬ��̼����λ���ɳ���4.SnC14���ֿ�������ṹ�ֱ��� ��
��4����H20��Ϊ�ȵ������һ�ֺ���̼Ԫ�ص�������Ϊ ���ѧʽ����H20
��CH3CH20H��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ
��5��Ԫ��X��ij��̬����X}+�����е������ó���K, L, M�������Ӳ㣬����
N3һ�γɵľ���ṹ��ͼ��ʾ��

���þ�����������������Ӹ�����Ϊ
���þ�����Xnʮ������n=
��������ÿ��N3һ�� ���Ⱦ����Xn+���Ӱ�Χ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��X(g)+2Y(g)![]() 2Z(g)��2M(g)
2Z(g)��2M(g)![]() N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܱո��塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ(�������෴Ӧ���¶���ͬ)�������ж���ȷ���ǣ�
N(g)+P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܱո��塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ(�������෴Ӧ���¶���ͬ)�������ж���ȷ���ǣ�

A����Ӧ��������Ӧ�����ȷ�Ӧ
B����ƽ��(I)ʱ��ϵ��ѹǿ�뷴Ӧ��ʼʱ��ϵ��ѹǿ֮��Ϊ14:15
C����ƽ��(I)ʱX��ת����Ϊ5/11
D����ƽ��(I)��ƽ��(II)��M�����������ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com