
【题目】铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是 。
(2)步骤②加入过量氯水的作用是___________,反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)下列操作会导致所测定的铁元素含量偏高的是______。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
(6)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 溶液,若溶液变成______色,说明该补血剂已变质。
【答案】(1)500mL容量瓶、胶头滴管
(2)将Fe2+全部氧化为Fe3+; 2Fe2++Cl2=2Fe3++2Cl-
(3)过滤
(4)70n/m %
(5)BC
(6)KSCN;红
【解析】
试题分析:(1)由浓溶液配制稀溶液所需的仪器有量筒、烧杯、玻璃棒、500mL容量瓶和胶体滴管,因为浓溶液已经量取,所以配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是500mL容量瓶和胶体滴管。
(2)氯水具有强氧化性,由流程图可知,加入氯水目的是将Fe2+全部氧化为Fe3+;反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量。
(4)ng氧化铁的物质的量为ng÷160g/mol=n/160mol,含有的铁元素质量为:2×n/160×56g=7n/10,则补血剂中含铁元素的质量分数为7n/10m×100%=70n/m %。
(5)A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,A错误;B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,B正确;C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,C正确;答案选BC。
(6)若补血剂变质,则补血剂中Fe2+被氧化为Fe3+,只需检验是否存在Fe3+即可,则取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加KSCN溶液,若溶液变成红色,说明该补血剂已变质。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的 L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_______________元素,B为_______________元素;C为_______________元素。D的质子数和中子数相等,D的原子组成符号为_____________,它的最高价为__________价。
(2)用电子式表示A、D两元素形成AD2的过程:______________________________,用电子式表示C、D两元素形成化学键的过程:______________________________。
(3)写出E和A的最高价氧化物反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池原理如右图所示,电池总反应为Zn+2NH===Zn2++2NH3↑+H2↑。下列说法正确的是( )

A.Zn极上发生还原反应
B.碳电极上发生还原反应
C.常见锌锰干电池为二次电池
D.负极上发生的反应为2NH+2e-===2NH3↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如下图实验:

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O 4和SO2气体,实验后取d中溶液的1/10 置于锥形瓶中,用0.05mol/L 标准碘溶液进行滴定,消耗标准溶液 20mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是________________________。
(2)装置a和c的作用分别是_______和________(填标号,可以多选)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)滴定达终点时的现象是________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(5)通过计算可知,该黄铜矿的纯度为________________________。
乙同学在甲同学实验的基础上,设计了两种与甲不同的吸收方法,并对吸收产物进行有关处理,同样也测出了黄铜矿的纯度。
(6)方法一:用如下图装置替代上述实验装置 d,同样可以达到实验目的是______(填序号)。

(7)方法二:将原装置 d 中的试液改为Ba(OH)2,但测得的黄铜矿纯度却产生了+1%的误差,假设实验操作均正确,可能的原因主要有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做
一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。

①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中,正确的是( )
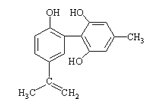
A.滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
B.1mol该物质分别与浓溴水和H2反应时最多消耗溴水和H2分别为4mol和7mol
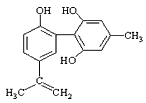 C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:①CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
②F的结构简式:
以下是该有机物F的合成路线,请填写下列空白。

(1)写出下列物质的结构简式A ,C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)写出与D互为同分异构体,结构中含有苯环且苯环上含有一个乙基(苯环上的取代基处于对位)的酯类的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置为______;UW2的电子式为______;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是______、______。
(2)U、V、W形成的10电子氢化物中,最稳定的是______(写化学式、下同);沸点最高的是______;结合H+能力最强的是(写化学式)______。
(3)Z3W4与稀盐酸反应的离子方程式为______。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为______,由此可知VW和YW2还原性较强的是(写化学式)______。
(5)已知YW2和Cl2均可使品红溶液褪色,现将一定量的YW2和Cl2通入品红溶液中:
①若品红不褪色,则品红溶液中所发生的化学方程式为______。
②若品红褪色,为证明YW2和Cl2谁过量,最简单的操作、现象、结论是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工 业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:


(1)几种盐的溶解度见上图。反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、________________、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是___________________。
(3)反应Ⅳ的化学方程式为_______________________。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为____________________。
(5)上图煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为_____________________。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com