
【题目】A、B、C、D四种元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的 L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_______________元素,B为_______________元素;C为_______________元素。D的质子数和中子数相等,D的原子组成符号为_____________,它的最高价为__________价。
(2)用电子式表示A、D两元素形成AD2的过程:______________________________,用电子式表示C、D两元素形成化学键的过程:______________________________。
(3)写出E和A的最高价氧化物反应的化学方程式:________________________________。
【答案】(1)碳 氧 钠![]() +6(2)
+6(2)![]()
![]()
(3)2Na2O2+2CO2====2Na2CO3+O2
【解析】试题分析:因B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,可知E为过氧化钠,B为氧元素,C为钠元素;D的L层电子数 等于K、M两个电子层上的电子数之和,所以K、L、M三个电子层上的电子数分别为2、8、6,可知D为硫元素;A、B、C、D四种元素,原子序数依次增 大,A原子的最外层上有4个电子,可知A为碳元素;
(1)由以上分析可得A为碳,B为氧元素,C为钠元素,D的原子组成符号为![]() ,它的最高价为+6价。
,它的最高价为+6价。
(2)A、D两元素形成AD2是二氧化碳,其形成过程为:![]() ,C、D两元素形成的化合物是硫化钠,形成过程是:
,C、D两元素形成的化合物是硫化钠,形成过程是:![]() 。
。
(3)E是过氧化钠,A的最高价氧化物是二氧化碳,反应的化学方程式:2Na2O2+2CO2====2Na2CO3+O2。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】I.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1) CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
△H=-44.0kJ·mol-1,则a=______kJ·mol-1。
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图,下列有关说法不正确的是_______(填序号)

①温度越高,催化剂的催化效率越高
②温度低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”。右图是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O。

阴极的电极反应式为::_________________________
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如下图:


①表中a=___________。
②实验说明,该反应是__________反应(填“放热”或“吸热”)。
③若在500℃时,投料=1,NO的转化率为80%,则此温度时的平衡常数K=_____。
(5)使用电化学法也可处理NO的污染,装置如右图。已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:__________。吸收池中除去NO的离子方程式为:__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围广。请回答下列问题:
(1)制备硅半导体材料必须先得到高醇硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式 .
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种物质。写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 .
(2)下列有关硅材料的说法正确的是 (填字母)。
A.高纯度的硅,可用于生产光电池,将光能直接转换为电能
B.氮化硅硬度大.熔点高.可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料----光导纤维
D.普通玻璃是由纯碱.石灰石和石英砂制成的
E.盐酸可以与硅反应.故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: 。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠可大量用于染料和有机合成工业。请回答下列问题:
(1)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种活性气体,该气体在空气中迅速变色。写出反应的离子方程式 。
(2)实验室模拟用如图所示装置通过如下过程制备亚硝酸钠:


已知:(I)氧化过程中,控制反应液的温度在35~60℃条件下发生的主要反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
(II)氢氧化钠溶液吸收NO、NO2发生如下反应:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O
①A中反应温度不宜高于60℃,原因是 。
②不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH外还有两种阴离子,其中一种是NO2,NO2与另一种阴离子的物质的量之比为 。
③B装置用于制备NaNO2,盛装的试剂除NaOH外,还可以是 。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3(aq)
(3)测定产品纯度:
I.准确称量ag产品配成100 mL溶液;
II.从步骤I配制的溶液中移取20.00 mL加入锥形瓶中;
III.用c mol·L1酸性KMnO4溶液滴定至终点;
IV.重复以上操作3次,消耗KMnO4酸性溶液的平均体积为V mL。
①锥形瓶中发生反应的离子方程式为 。
②滴定至终点的现象为 。
③产品中NaNO2的纯度为 (写出计算表达式)。
④若滴定终点时俯视读数,则测得的产品中NaNO2的纯度 (填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W结构中含有三个六元环,是一种新型香料的主要成分之一。W的合成路线如下(部分产物和部分反应条件略去):
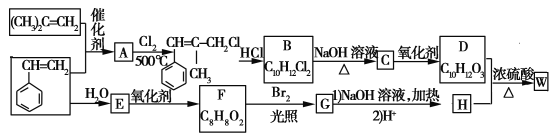
已知:①RCH===CH2+CH2===CHR′CH2===CH2+RCH===CHR′
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子
③D和H是同系物
请回答下列问题:
(1)G分子中含有的官能团名称是 。
(2)A→B反应过程中涉及的反应类型有 、 。
(3)W的结构简式为 。
(4)B→C的化学方程式为 ;由D生成高分子化合物的方程式为 。[
(5)同时满足下列条件的F的同分异构体有 种(不包括立体异构):
①能发生银镜反应;②能发生水解反应。
其中核磁共振氢谱为5组峰的为 (写结构简式),其峰面积之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥中含有多种贵重金属,从中提取金、银、铂的一种工艺如下:
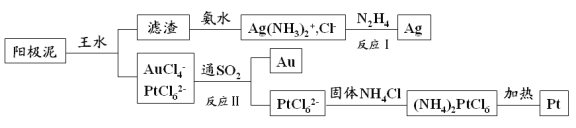
(1)王水是 的混合液,其体积比为 。
(2)滤渣的成分是 ,反应Ⅰ中肼(N2H4)的作用是 。
(3)反应Ⅱ的离子方程式为 ;当生成19.7gAu时,25℃和101kPa下反应消耗 L SO2(此条件下的气体摩尔体积为24.5L/mol,相对原子质量Au:197)。
(4)电解法精炼银时,粗银应与直流电源的 极(填“正”或“负”)相连,当用AgNO 3 和HNO 3 混合溶液做电解质溶液时,发现阴极有少量红棕色气体,则产生该现象的电极反应式为 。
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:4
C.无法确定该化合物是否含有氧元素
D.该化合物一定是C2H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是 。
(2)步骤②加入过量氯水的作用是___________,反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)下列操作会导致所测定的铁元素含量偏高的是______。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
(6)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 溶液,若溶液变成______色,说明该补血剂已变质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com