
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
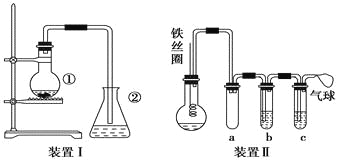
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置Ⅰ中①中的化学方程式为______________________________________。
②中离子方程式为_______________________________________。
(2)①中长导管的作用是__________________________。
(3)烧瓶中褐色油状液滴中有机物的成分是________,要想得到纯净的该产物,可用______ __洗涤。洗涤后分离粗产品应使用的仪器是____ ____。
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是_______________________________________。
b中的试剂是____________________________________。
比较两套装置,装置Ⅱ的主要优点是
_____________________________________________________________
_____________________________________________________________。
【答案】(1)2Fe+3Br2===2FeBr3![]()
(2)导气,冷凝回流
(3)![]() 与Br2NaOH溶液 分液漏斗
与Br2NaOH溶液 分液漏斗
(4)防止倒吸安全装置 苯或四氯化碳
主要优点是:①防止倒吸 ②可以控制反应进行程度 ③避免杂质干扰 ④防止污染空气
【解析】试题分析:(1)因溴与铁反应生成溴化铁:2Fe+3Br2 ═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢:C6H6+Br2![]() C6H5Br+HBr;
C6H5Br+HBr;
(2)反应为放热反应,长导管让挥发出来的溴单质冷凌,防止对产物的干扰,即长导管的作用为导气,冷凝回流。
(3)反应生成的硝基苯和溴互溶呈红褐色油状液滴。可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液,故答案为![]() 与Br2NaOH溶液 分液漏斗。
与Br2NaOH溶液 分液漏斗。
(4)从图上信息可知,支管是短进短出a的的作用是防止倒吸安全装置。B中要除去Br2,试剂为苯或四氯化碳。根据以上分析,装置Ⅱ的主要优点是①防止倒吸;②可以控制反应进行程度;③避免杂质干扰;④防止污染空气。


科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)H2C2O4 (s) ![]() H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
A.恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态
B.恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态
C.气体摩尔体积不再发生变化,说明该反应已达到化学平衡状态
D.气体平均摩尔质量不再发生变化,说明该反应已达到化学平衡状态
(2)草酸分解所需燃料可以是CO,通过甲烷制备CO:
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H >O。常温下,在2 L的密闭容器中通入4 mol CH4气体和6 mol CO2气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1 mol·L-1。
①平衡时,该反应的平均反应速率v(CO2)= mol·L-1min-1。
②在不改变反应混合物用量的前提下,为了提高CH4气体的转化率,可采取的措施是 。
(3)电解饱和草酸溶液可以制得高档香料乙醛酸(H2C2O3),装置如下图1所示,写出复合膜电极的电极反应式 。

(4)在K3Fe(C2O4)3溶液中存在:[Fe(C2O4)3]3-Fe3++3C2O42-,常温下,该溶液中
[Fe(C2O4)3]3-的浓度与温度的关系如上图2所示,则A点的c(Fe3+) B点的c(Fe3+) (填“<”“>”或“=”);草酸是一种温和的还原剂,其他条件不变,向K3Fe(C2O4)3溶液中加入少量KMnO4固体,Fe3+的浓度 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如下图实验:

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O 4和SO2气体,实验后取d中溶液的1/10 置于锥形瓶中,用0.05mol/L 标准碘溶液进行滴定,消耗标准溶液 20mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是________________________。
(2)装置a和c的作用分别是_______和________(填标号,可以多选)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)滴定达终点时的现象是________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(5)通过计算可知,该黄铜矿的纯度为________________________。
乙同学在甲同学实验的基础上,设计了两种与甲不同的吸收方法,并对吸收产物进行有关处理,同样也测出了黄铜矿的纯度。
(6)方法一:用如下图装置替代上述实验装置 d,同样可以达到实验目的是______(填序号)。

(7)方法二:将原装置 d 中的试液改为Ba(OH)2,但测得的黄铜矿纯度却产生了+1%的误差,假设实验操作均正确,可能的原因主要有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中,正确的是( )
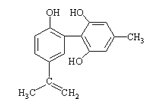
A.滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
B.1mol该物质分别与浓溴水和H2反应时最多消耗溴水和H2分别为4mol和7mol
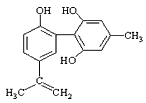 C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:①CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
②F的结构简式:
以下是该有机物F的合成路线,请填写下列空白。

(1)写出下列物质的结构简式A ,C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)写出与D互为同分异构体,结构中含有苯环且苯环上含有一个乙基(苯环上的取代基处于对位)的酯类的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫的化合物与人类生活和生产有着密切的联系。请回答下列问题:
(1)在空气质量报告的各项指标中,有SO2和NO2的指数,SO2是一种无色有毒气体,NO2是一种 (填“无色”或“红棕色”)有毒气体;
(2)氨气极易溶于水,其水溶液显 (填“酸”、“碱”或“中”)性;
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出 (填“吸水”、“脱水”或“氧化”)性。
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出 (填“吸水”、“脱水”或“氧化”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置为______;UW2的电子式为______;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是______、______。
(2)U、V、W形成的10电子氢化物中,最稳定的是______(写化学式、下同);沸点最高的是______;结合H+能力最强的是(写化学式)______。
(3)Z3W4与稀盐酸反应的离子方程式为______。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为______,由此可知VW和YW2还原性较强的是(写化学式)______。
(5)已知YW2和Cl2均可使品红溶液褪色,现将一定量的YW2和Cl2通入品红溶液中:
①若品红不褪色,则品红溶液中所发生的化学方程式为______。
②若品红褪色,为证明YW2和Cl2谁过量,最简单的操作、现象、结论是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色。
(1)C元素在元素周期表中的位置 。B形成的简单离子的结构示意图 。
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物中所含化学键类型为 。
(5)GE2的电子式为 ,F与G形成的最简单的化合物的结构式为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:

(1)常温下含碳量最高的气态烃是________(填对应字母)。
(2)能够发生加成反应的烃有________(填数字)种。
(3)一卤代物种类最多的是________(填对应字母)。
(4)写出C与溴水反应的化学方程式:______________________。
(5)写出F发生溴代反应的化学方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com