
【题目】在2L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。达到平衡时NO的转化率为_______
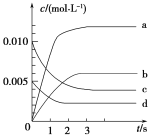
(2)能说明该反应已达到平衡状态的是________(填字母序号,下同)。
A.v (NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
A.增加容器体积 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
【答案】(1)b 1.5×10-3mol·L-1·s-1 65%
(2)bc
(3)bcd
【解析】
试题分析: (1)下图表示消耗NO 0.013mol,所以生成NO20.013mol,NO2的浓度是0.0065mo,表示NO2的变化的曲线是b。用O2表示从0~2 s内消耗NO 0.012mol,则消耗O2 0.006mol,该反应的平均速率v=![]() 1.5×10-3mol·L-1·s-1。达到平衡时NO的转化率为
1.5×10-3mol·L-1·s-1。达到平衡时NO的转化率为![]() =65%
=65%
(2)v (NO2)=2v(O2) 都是正反应速率,不一定平衡;反应前后气体物质的量是变量,容器内压强是变量,压强保持不变时一定平衡;
正逆反应速率比等于系数比,v逆(NO)=2v正(O2)一定平衡 ;![]() ,混合气体在质量是恒量,故密度是恒量,混合气体的密度不变时,不一定平衡。
,混合气体在质量是恒量,故密度是恒量,混合气体的密度不变时,不一定平衡。
(3)增加容器体积,反应物浓度减小,反应速率减慢;适当升高温度,反应速率加快;
增大O2的浓度,反应速率加快;选择高效催化剂能加快反应速率。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】碳、氮在自然界中广泛存在。
(1)CH3COOH中C原子轨道杂化类型有;1molCH3COOH分子中含有![]() 键的数目为
键的数目为
(2)50号元素Sn在周期表中位置是 ;写出50号元素Sn的基态原子核外电子排布式
(3)锡和碳一样能生成四氯化物(SnC14),然而锡又不同于碳,配位数可超过4.SnC14两种可能立体结构分别是 和
(4)与H20互为等电子体的一种含有碳元素的阳离子为 (填化学式);H20
与CH3CH20H可以任意比例互溶,除因为它们都是极性分子外,还因为
(5)元素X的某价态离子X}+中所有电子正好充满K, L, M三个电子层,它与
N3一形成的晶体结构如图所示。

①该晶体的阳离子与阴离子个数比为
②该晶体中Xn十离子中n=
③晶体中每个N3一被 个等距离的Xn+离子包围。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)②2M(g)
2Z(g)②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:

A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时X的转化率为5/11
D.在平衡(I)和平衡(II)中M的体积分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是 。
A.2mol/LNa2CO3溶液
B.品红溶液
C.0.5mol/L BaCl2溶液
D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数= (精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(物质结构与性质)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)元素B、G形成的单质熔点更高的是_ ___(填化学式),原因是____ _
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的有机产物,肯定是一种的是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2—氯丁烷(![]() )与NaOH溶液共热发生反应
)与NaOH溶液共热发生反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 等物质的量的甲烷和氯气的混和气体长时间光照后的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。

(1)上表中与A属于同一周期的元素是 (填元素名称);写出B的单质的电子式 。
(2)D和B形成的化合物的化学式为 。
写出A单质与水反应的离子方程式 。
(3)对B、C的单质或化合物描述正确的是 。
a.C元素的最高正价为+7 b.常温、常压下C单质性质稳定
c.B的氧化物只有两种 d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④ 电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应 d.置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
![]()

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为 (注明反应条件)。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________,目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是____________________。
(3)烧杯B的作用是___________________________,烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找)。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.①![]() H与
H与![]() H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷![]() ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______ (填序号,下同)。 (2)互为同系物的是______。
(3)互为同分异构体的是______。 (4)互为同素异形体的是______。
II.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题。

(1)D的电子式为___________,A的二氯取代物有 种。
(2)可作为植物生长调节剂的是 (填结构简式);
(3)A与氯气反应可以生成多种物质,试任写其中一个反应的化学方程式: ;
(4)C与水在一定条件下反应的化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com