
����Ŀ���ı�����ϩ(TPE)��������������յ��������ԣ��ڹ����ϵ�����Ӧ��ǰ���㷺��������TPE�������ϳ�·��(�����Լ�����Ӧ����ʡ��)��

��1��A�������� ���Լ�YΪ ��
��2��B��C�ķ�Ӧ����Ϊ ��B�й����ŵ������� ��
D�й����ŵ������� ��
��3��E��F�Ļ�ѧ����ʽ�� ��
��4��W��D��ͬ���칹�壬�������нṹ����������������![]() ����һԪȡ���
����һԪȡ���
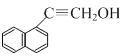
�ڴ����Ǽ�(��CH2OH)��д��W���п��ܵĽṹ��ʽ�� ��
��5������������ȷ����______��
a. B�����Աȱ���ǿ
b. D���ܷ�����ԭ��Ӧ
c. E����3�ֲ�ͬ��ѧ��������
d. TPE�����ڷ�����Ҳ����ϩ��
���𰸡���1���ױ� ���Ը������
��2��ȡ����Ӧ �Ȼ� ���ʻ�
��3��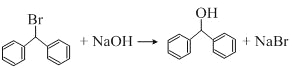
��4��![]()
��5��a d
��������
�����������1���ױ��ɱ����Ը����������Ϊ�����ᣬ��A�Ǽױ���Y�����Ը�����أ�
��2��B��C�ķ�Ӧ����Ϊȡ����Ӧ��B�й����ŵ��������Ȼ���D�й����ŵ��������ʻ���
��3��E��F��±������ˮ�⣬��ѧ����ʽ�� ��
��
��4��W��D��ͬ���칹�壬�������нṹ����������������![]() ����һԪȡ����ڴ����Ǽ�(��CH2OH)����W���п��ܵĽṹ��ʽΪ
����һԪȡ����ڴ����Ǽ�(��CH2OH)����W���п��ܵĽṹ��ʽΪ![]() ��
�� ��
��
��5��a. �����������Աȱ���ǿ����ȷ��b. D�к����ʻ�������������ԭ��Ӧ������c. E����4�ֲ�ͬ��ѧ��������������d. TPE�����ڷ�����Ҳ����ϩ������ȷ����ѡad��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з����˷ܼ�����ʧ��ƽ��Ҳ�ܻ����������¡�ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʵ�˵���У���ȷ����( )
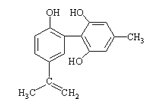
A���������Ը��������Һ����ɫ��ȥ����֤����ṹ�д���̼̼˫��
B��1mol�����ʷֱ���Ũ��ˮ��H2��Ӧʱ���������ˮ��H2�ֱ�Ϊ4mol��7mol
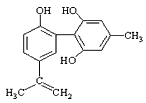 C���������뱽������ͬϵ���FeCl3��Һ����ɫ
C���������뱽������ͬϵ���FeCl3��Һ����ɫ
D���÷����е�����̼ԭ�Ӳ����ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɡ������ǰ��ֶ�����Ԫ�ص������Ϣ����֪���ԭ�Ӱ뾶Ϊ0.089 nm��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +2 | +3 | +6����2 | ��1 | ��2 |
Fԭ���������ӣ�G����������븺������ȣ��������������Ǵ����Ķ�����HԪ�ص�����ɫ��Ӧ�ʻ�ɫ��
��1��CԪ����Ԫ�����ڱ��е�λ�� ��B�γɵļ����ӵĽṹʾ��ͼ ��
��2����������Ԫ�ص�����������Ӧ��ˮ������������ǿ���� ���ѧʽ����
��3���õ���ʽ��ʾA��D�γɻ�����Ĺ��̣� ��
��4��H��E�γ�ԭ�Ӹ�����Ϊ1��1�Ļ�������������ѧ������Ϊ ��
��5��GE2�ĵ���ʽΪ ��F��G�γɵ���Ļ�����ĽṹʽΪ ��
��6��E���⻯���C���⻯����۷е�ߵ�ԭ���� ��
��7��A��B��C��Eԭ�Ӱ뾶�ɴ�С��˳��Ϊ(��Ԫ�ط��ű�ʾ) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿���Ҫ�ɷ�ΪMnO2������������ز����������У�������18����MnO2��3����KOH����Ϊ������������������Cu��Pb�Ļ�����ȣ�������ɻ�����ȡMnCO3��������ͼ��

��1��������ص�������ǿ������Һ��������йأ��������������������Խ�ǿ��ͨ�������ữ������ص�����
��2����ȥ��Һ1��Cu2�������ӷ���ʽ��
��3����ʵ��֤����MnO2�Թ���ʱ����ʼH2SO4��FeSO4�����Һ��c��H������![]() <0.7ʱ����Һ1���ܹ��������Fe
<0.7ʱ����Һ1���ܹ��������Fe![]() ��
��![]() ��0.7ʱ����Һ1�в��ܼ������Fe2��������������Ϣ�ش��٢ڢ���
��0.7ʱ����Һ1�в��ܼ������Fe2��������������Ϣ�ش��٢ڢ���
������Fe2���Ƿ�������ȫ��ʵ�������__________��
������ʱH2SO4��FeSO4�����Һ��c��H������c��Fe2����������0.7��1֮�䣬���˹�����ӽ�ԼҩƷ�ĽǶȷ�����ԭ����__________��
����c��H������c��Fe2����>1������c��H������c��Fe2������0.7��1���������Լ��ǣߣ�����ţ�
a��NaOH��Һ B������ c��MnO��
��4��д����Һ2�м������NH4HCO3��Ӧ�����ӷ���ʽ__________��
��5�����������̻����ʿɴ�95����������1740 kg�����࣬������MnCO3__________kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2SO4���������ʼطʣ�Mn3O4������������������ϵ���Ҫԭ�ϡ������Ṥ ҵ��β�������Ʊ�K2SO4��Mn3O4�Ĺ����������£�


��1�������ε��ܽ�ȼ���ͼ����Ӧ���У���NH4��2SO4��Һ�м���KCl��Һ��ַ�Ӧ��������Ũ����________________��ϴ�ӡ�����Ȳ�������K2SO4��Ʒ��
��2������K2SO4��Ʒ�Ƿ����Ȼ������ʵ�ʵ�������___________________��
��3����Ӧ���Ļ�ѧ����ʽΪ_______________________��
��4��Mn3O4��Ũ�������ʱ������Ӧ�����ӷ���ʽΪ____________________��
��5����ͼ����MnSO4��H2Oʱ�¶���ʣ����������仯���ߡ�
����������B������ʾ���ʵĻ�ѧʽΪ_____________________��
�����չ����й����̺������¶ȵ����߶��������¶ȳ���1000��ʱ������ȴ��ò�������̺���������С���Է����������̺�����С��ԭ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[ѡ��3�����ʽṹ������]��ijԪ��X�˵����С��18����ԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1��ԭ�Ӻ�����������2n2-1�������й�X��˵���У�����ȷ����
A��X ���γɻ�ѧʽΪX(OH)3�ļ�
B��X �����γɻ�ѧʽΪNaXO3�ĺ���������
C��X ԭ�ӵ������������ͺ˵����������Ϊż��
D��X ����ijЩ����Ԫ�ػ�ǽ���Ԫ���γɻ�����
����֪ A��B��C��D��E ����Ԫ�����ڱ���ԭ������С��36��Ԫ�أ������ǵĺ˵������������Bԭ�ӵ�p�����������γɵ��⻯��ķе���ͬ����Ԫ�ص��⻯������͵ġ�Dԭ�ӵõ�һ�����Ӻ� 3p ���ȫ������A+��Dԭ���γɵ�������һ�����Ӳ㡣C��A�γ�A2C�����ӻ����E��ԭ������Ϊ26��Eԭ�ӻ�������Χ�н϶���������Ŀչ��������һЩ���ӻ������γ����� ���������������ش��������⣺
��1��EԪ��ԭ�ӵĺ�������Ų�ʽ�� ��
��2��A��B��C��D�ĵ�һ��������С�����˳��Ϊ �� (��Ԫ�ط��ű�ʾ)
��3��B Ԫ�ص��⻯��ķе���ͬ����Ԫ�ص��⻯������͵�ԭ���� ��
��4��������BD3�ķ����У�ԭ��B���ӻ������ �����ӿռ乹���� ��
��5��E ��һ�ֳ��������E(CO)5�����³�Һ̬���۵�Ϊ-20.5�����е�Ϊ103���������ڷǼ����ܼ��� �ݴ˿��ж�E(CO)5�ľ�������Ϊ ������ E ���ʵľ����ڲ�ͬ�¶��������ֶѻ���ʽ�������ֱ���ͼ��ʾ������������������������������ʵ�ʺ��е�Eԭ�Ӹ���֮��Ϊ ��
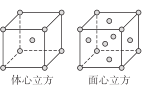
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G�Ǽ������ķ������ģ�ͣ��ݴ˻ش��������⣺

��1�������º�̼����ߵ���̬����________(���Ӧ��ĸ)��
��2���ܹ������ӳɷ�Ӧ������________(������)�֡�
��3��һ±��������������________(���Ӧ��ĸ)��
��4��д��C����ˮ��Ӧ�Ļ�ѧ����ʽ��______________________��
��5��д��F���������Ӧ�Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����͵��Ҵ���أ����û����������ܼ�������ܷ�ӦΪ��C2H5OH +3O2�� 2CO2+3H2O,���ʾ����ͼ,����˵����ȷ����

A. a��Ϊ��ص�����
B. ��ع���ʱ������a���ص��߾������ٵ�b��
C. ��ظ����ĵ缫��ӦΪ��4H++ O2+ 4e��= 2H2O
D. ��ع���ʱ,1mol�Ҵ�������ʱ����12mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯��ͭ��Cu2I2����һ�ֲ�����ˮҲ��������İ�ɫ���壬��;�ܹ㷺�����������գ�
��1���⻯����Һ�еμ���������ͭ��Һ�����ܵõ��⻯��ͭ��д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2)��������Ӧ����Һ�м�����ۣ���Һ�������ٵμ���������Һ����ɫ����ȥ��д��KI��Cu2I2��H2SO3�Ļ�ԭ����ǿ������˳����_____________ _ ______��
��3���⻯��ͭ�����ڼ������еĹ��������䷴ӦΪ��2Cu2I2 + Hg��Cu2HgI4(õ���)+ 2Cu������Cu2HgI4��CuԪ����____�ۡ�����1 molCu2I2���뷴Ӧʱ��ת�Ƶ���____mol��
��4��Ϊ��ȥϡ����������CuCl2���ʣ�������Һ�м��������M�Լ�����й��˲�������ͨ��������Cl2�����N�������Լ�M�Ͳ���N�������ȷ����_____��ѡ���ţ�

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com