
【题目】根据最新报道,贵州发现超大型锰矿,整个矿区资源量超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家战略紧铁矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、清费大国,回答下列问题:
(1)基态锰原子的价层电子排布式为_________。
(2)铜锰氧化物(CuMn2O4) 能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
①CO 和N2 互为等电于体。CO 分子中σ键和π键数目之比为________。
②HCHO分子的H-C-H 键角______(填“大于”“小于”或“等于”)CO2的键角,理由是__________。
③ 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶被中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。CO32-的空间构型是____________。
(3)晶体熔点: Fe2O3晶体______Al2O3晶体(填“>”“<”或“=”),理由是___________。
(4)锰、铁的第三电离能(I3) 较大的是_______(填素符号)。
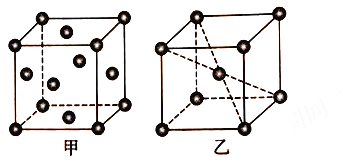
(5) 铝晶胞如图26甲所示。铝晶胞中,铝原子的配位数为________。已知铝的晶体密度为ρ g·cm-3,N A代表阿伏加德罗常数的值,设铝原子的半径为rpm,则r=_______。
(6)锰晶胞如图乙所示。已知锰晶胞参数为a nm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_____。锰晶胞中Mn 的空间利用率φ=____________。
【答案】 3d54s2 1︰2 小于 HCHO中C为sp2杂化,CO2中C为sp杂化 < 平面三角形 氧化铝、氧化铁都是离子晶体,铝离子半径小于铁离子,氧化铝的晶格能较大 Mn 12 ![]()
![]()
![]()
【解析】(1)锰是25号元素,3d和4s上的电子是其价电子,根据构造原理知其价电子排布式为:3d54s2 ;(2)①CO与N2结构相似,CO分子中σ键与π键数目之比为1:2;②HCHO中C为sp2杂化,CO2中C为sp杂化,在中心原子无孤对电子的情况下,sp杂化键角为180°,sp2杂化键角为120°,故HCHO分子的H-C-H键角小于CO2的键角;③CO32-中C原子形成3个δ键,没有孤电子对,则应为平面三角形;(3)氧化铝、氧化铁都是离子晶体,铝离子半径小于铁离子,氧化铝的晶格能较大,故晶体熔点:Fe2O3晶体<Al2O3晶体;(4)铁、锰的价电子排布式分别为3d64s2、3d54s2,当锰失去2e后3d轨道为半满,所以失去第三个电子所需的能量高,故锰、铁的第三电离能(I3)较大的是Mn;(5)铝为面心立方最密堆积,配位数为12;设晶胞边长为![]() ,面对角线(即4个原子半径)
,面对角线(即4个原子半径)![]() ,
,![]() ,根据
,根据![]() ,
,![]() ;(6)设锰原子的半径为
;(6)设锰原子的半径为![]() nm,体对角线(即4个原子半径)
nm,体对角线(即4个原子半径)![]() ,
, ![]() ,两原子核间最短距离是顶角到体心的距离(即2个原子半径),
,两原子核间最短距离是顶角到体心的距离(即2个原子半径),![]() 。锰晶胞中锰的空间利用率等于两个锰原子的体积除以立方体的体积,即
。锰晶胞中锰的空间利用率等于两个锰原子的体积除以立方体的体积,即![]() (或68%)。
(或68%)。


科目:高中化学 来源: 题型:
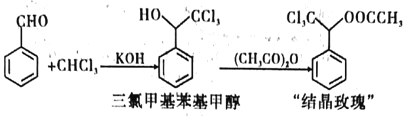
【题目】“结晶玫瑰”是具有强烈玫瑰香气的结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。其化学名称为“乙酸三氯甲基苯甲酯”,目前国内工业上主要使用以下路径来合成结晶玫瑰:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶政瑰”。
已知:
三氯甲基苯基甲醇 | 相对分子质量:225.5。无色液体。不溶于水,密度比水大,溶于乙醇 |
乙酸酐 | 无色液体。与水反应生成乙酸,溶于乙醇 |
“结晶玫瑰” | 相对分子质量:267.5。白色晶体。熔点:88℃。不溶于水,溶于乙醇 |
具体实验步骤如下:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
步骤一:装置如图所示。依次将苯甲醛、氯仿加入三颈烧瓶中,仪器A中加入KOH和助溶剂。滴加A中试剂并搅拌,开始反应并控制在一定温度下进行。

步骤二:反应结束后,将混合物依次用5%的盐酸、蒸馏水洗涤。
步骤三:将洗涤后的混合物蒸馏,除去其他有机杂质,加无水琉酸镁,过滤。滤液即为粗制三氯甲基萃基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶玫瑰”。
步骤四:向另一三颈瓶中加入制备的三氯甲基苯基甲醇、乙酸酐,并加入少量浓硫酸催化反应,加热控制反应温度在90℃~110℃之间。
步骤五:反应完毕后,将反应液倒入冰水中,冷却结晶获得“结晶玫瑰”。
请回答下列问题:
(1)仪器A的名称是_________。实验装置B中,冷凝水应从_____口进(填“a”或“b”)。
(2)步骤二中,用5%的盐酸洗涤的主要目的是___________。在洗涤、分液操作中,应充分振荡,然后静置,待分层后有机层应___________ (填序号)。
A.直接从上口倒出
B.先将水层从上口倒出,再将有机层从下口放出
C.直接从下口放出
D.先将水层从下口放出,再将有机层从下口放出
(3)步骤三中,加入无水硫酸镁的目的是___________。若未加入无水硫酸镁,直接将蒸馏所得物质进行后续反应,会使“结晶玫瑰”的产率偏______(填“高”或“低”),其原因是___________ (利用平衡移动原理解释)。(已知Ⅱ的具体反应如图所示)

(4)步骤四中,加料时,应先加入三氯甲基苯基甲醇和乙酸酐,然后慢慢加入浓硫酸并搅拌,主要是为了__________。加热反应时,为较好的控制温度,最适宜的加热方式为_____(填“水浴加热”或“油浴加热”)。
(5)22.55g三氟甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰21.40g,则产率是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 质量相等的O2和O3中所含原子数相等
B. 物质的量相等的O2和O3中含分子数相等
C. 质量相等的CO和CO2中所含碳原子数相等
D. 物质的量相等的CO和CO2中含碳原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的NaOH溶液,两者pH都升高了1。则加入水和加入NaOH溶液的体积比约为( )
A. 11∶1 B. 10∶1 C. 6∶1 D. 5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A. 浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)
B. 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.得电子越多的氧化剂,其氧化性就越强
C.阳离子只有氧化性,阴离子只有还原性
D.有单质参加的反应不一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物有着广泛应用。
(1)在1.0 L密闭容器中放入0.10mol PCl5(g),一定温度进行如下反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH1
PCl3(g)+Cl2(g) ΔH1
反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
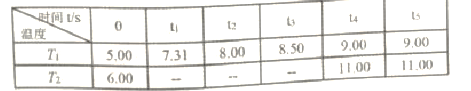
回答下列问题:
①PCl3的电子式为_______。
②T1温度下,反应平衡常数K=______。
③T1___T2(填“>”、“<”或“=”,下同),PCl5的平衡转化率α1(T1) __α2(T2)。
(2)PCl5、PCl3可转化为H3PO4、H3PO3。已知下列热化学方程式:
PCl5(g)+4H2O(l) = H3PO4(aq)+5HCl(aq) ΔH2
PCl3(g)+3H2O(l) = H3PO3(aq)+3HCl(aq) ΔH3
H3PO3(aq)+Cl2(g)+H2O(l) = H3PO4(aq)+2HCl(aq) ΔH4
则ΔH4= ______。(用ΔH1、ΔH2、ΔH3表示)
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。
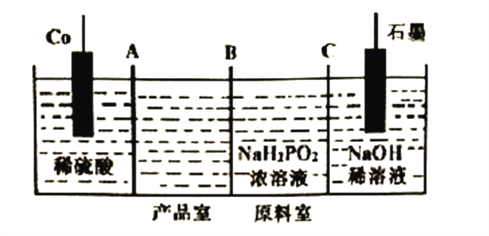
①Co的电极反应式为______________,A、B、C为离子交换膜,其中B为__________离子交换膜(填“阳”或“阴”)。
②次磷酸(H3PO2)为一元弱酸,次磷酸钠溶液中离子浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
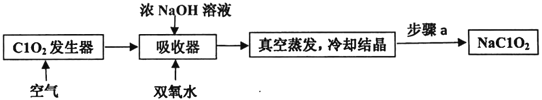
下列说法不正确的是
A. 步骤a的操作包括过滤、洗涤和干燥
B. 吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+
C. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、浯化能数据如下:
反应I: NO(g)+O3(g) ![]() NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
反应Ⅱ:SO2(g))+ O3(g)![]() SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g) ![]() 3O2(g) 请回答:
3O2(g) 请回答:
(1)已知反应I在低温下自发进行,则该反应的熵变△S___________0(填“大于”或“小于”)。
(2)其它条件不变,每次向反应器中充入含1.0 mol NO、10 mol SO2的模拟烟气和2.0 molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:
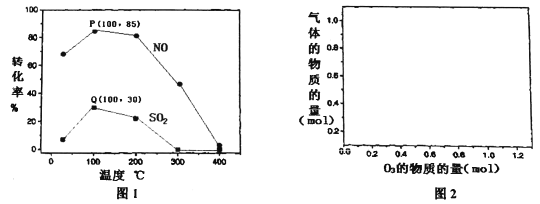
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_________。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是______mol。
③下列说法正确的是_______。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
(3)150℃条件下,向反应器中充入含1molNO、1molSO2的模拟烟气,在图2中分别画出NO和SO2的物质的量随O3量的变化曲线。________
(4)工业上可以通过电解NO制备NH4NO3,原理如图3所示。写出电解过程阳极的电极反应式_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com