
【题目】现有以异丁烯为原料合成某二酸的合成路线如图:
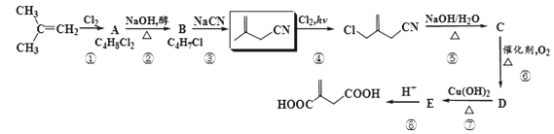
已知:R-CH2CN![]() R-CH2COONa+NH3
R-CH2COONa+NH3
(1)A的系统命名是__,B的官能团名称__。
(2)步骤③的反应类型是__。
(3)同一有机物中的两个同种官能团在反应时,一者参与反应占绝大多数,另一者几乎不反应,这被称之为“位置专一性”。请从反应物结构角度,简要解释步骤②中消去氯原子时的位置专一性:__。
(4)步骤⑤的产物C经酸化后,可发生分子内酯化,写出该内酯的结构简式___。
(5)写出步骤⑥的化学方程式__。
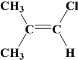
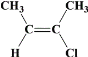
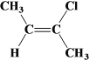
(6)均符合下列条件B的同分异构体为__。
a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰。
(7)利用题目给的信息,写出由异丁烯为原料,两步合成![]() 的路线流程___。
的路线流程___。
【答案】2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷 碳碳双键、氯原子 取代反应 因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应 ![]() 2
2![]() +O2
+O2![]() 2H2O+2
2H2O+2 ![]() 。
。  、
、 、
、
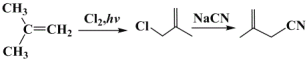
【解析】
![]() 与Cl2反应生成A,由A的分子式可确定其结构简式为
与Cl2反应生成A,由A的分子式可确定其结构简式为 ,它在NaOH醇溶液中发生消去反应生成B的结构简式为
,它在NaOH醇溶液中发生消去反应生成B的结构简式为![]() ,与NaCN发生取代反应生成
,与NaCN发生取代反应生成![]() ,
,![]() 与Cl2、hv作用下生成
与Cl2、hv作用下生成![]() ,依据信息可知,
,依据信息可知,![]() 在NaOH水溶液中加热,生成C的结构简式为
在NaOH水溶液中加热,生成C的结构简式为![]() ,C催化氧化生成D的结构简式为
,C催化氧化生成D的结构简式为![]() ,D再被Cu(OH)2氧化生成E的结构简式为
,D再被Cu(OH)2氧化生成E的结构简式为![]() ,E 与酸反应生成
,E 与酸反应生成![]() 。
。
(1)A的结构简式为 ,系统命名是2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷,B的结构简式为
,系统命名是2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷,B的结构简式为![]() ,官能团名称为碳碳双键、氯原子。答案为:2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷;碳碳双键、氯原子;
,官能团名称为碳碳双键、氯原子。答案为:2—甲基—1,2—二氯丙烷或1,2—二氯—2—甲基丙烷;碳碳双键、氯原子;
(2)步骤③为![]() 与NaCN反应生成
与NaCN反应生成![]() 和NaCl,反应类型是取代反应。答案为:取代反应;
和NaCl,反应类型是取代反应。答案为:取代反应;
(3)步骤②中, 在NaOH醇溶液中发生消去反应生成
在NaOH醇溶液中发生消去反应生成![]() ,消去氯原子时,邻位上必须存在氢原子,由此得出位置专一性的原因:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应。答案为:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应;
,消去氯原子时,邻位上必须存在氢原子,由此得出位置专一性的原因:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应。答案为:因为A物质中有一个Cl-官能团邻位无H原子,故它不易消去HCl而反应;
(4)步骤⑤的产物C为![]() ,经酸化后生成
,经酸化后生成![]() ,可发生分子内酯化,该内酯的结构简式为
,可发生分子内酯化,该内酯的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(5)步骤⑥中,![]() 催化氧化生成
催化氧化生成![]() ,化学方程式为2
,化学方程式为2![]() +O2
+O2![]() 2H2O+2
2H2O+2 ![]() 。答案为:2
。答案为:2![]() +O2
+O2![]() 2H2O+2
2H2O+2 ![]() ;
;
(6)B的结构简式为![]() ,满足条件:a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰,分子中的碳原子要么为双键碳原子,要么连在双键碳原子上,同分异构体为:
,满足条件:a.所有碳原子一定共平面;b.核磁共振氢谱有3组峰,分子中的碳原子要么为双键碳原子,要么连在双键碳原子上,同分异构体为: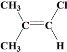 、
、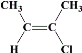 、
、 。答案为:
。答案为: 、
、 、
、 ;
;
(7)由![]() 制取
制取![]() ,只允许两步合成,则应为先用Cl2取代,后用NaCN取代,路线流程为
,只允许两步合成,则应为先用Cl2取代,后用NaCN取代,路线流程为 。答案为:
。答案为: 。
。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO和NOx,减轻其对大气的污染成为科研工作的热点问题。回答下列问题:
(1)已知下列热化学方程式:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=_________kJ·mol-1。
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变________实现的。
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是______。700K时,0~tmin内,体系中氨气的平均反应速率为______(用含t的式子表示)。
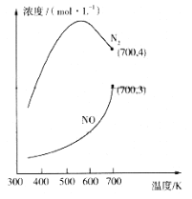
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)![]() 4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.96 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp =________kPa-1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡________(填“右移” “左移”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
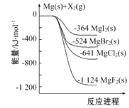
A. 热稳定性:MgF2>MgCl2>MgBr2>MgI2
B. 22.4LF2(g)与足量的Mg充分反应,放热1124kJ
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量
D. 由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H=-117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.工业合成氨反应中加压有利于提高氨气的产率
B.将NO2球浸泡在冷水和热水中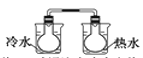
C.红棕色的NO2 ,加压后颜色先变深后变浅
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示:
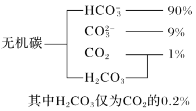
用离子方程式表示海水呈弱碱性的原因__。已知春季海水pH=8.1,预测夏季海水碱性将会__(填“增强”或“减弱”)
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是__(填字母)。
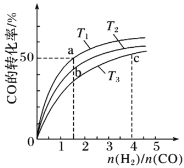
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
D.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
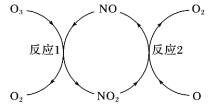
①NO的作用是__。
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为__。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
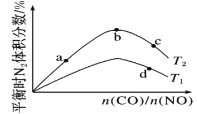
①b点时,平衡体系中C、N原子个数之比接近___。
②a、b、c三点CO的转化率从大到小的顺序为__;a、c、d三点的平衡常数从大到小的顺序为___。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___。
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在NH4NO3中氮元素显+5价;
②4FeS2+11O2![]() 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③2Cu+O2![]() 2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
A.①B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在指定溶液中大量共存的是
①无色溶液中:K+、Cl、Al3+、AlO2-、SO42-
②常温下,pH=14 的溶液中:CO32-、Na+、S2-、AlO2-
③室温下水电离的 c(H+)=10-13mol·L-1 的溶液:K+、HCO3-、Br-、Ba2+
④加入Al能放出H2的溶液中:NO3-、Cl-、Na+、SO42-
⑤中性溶液中:Cl-、NO3-、Na+、Fe3+
⑥室温下![]() =1012 的溶液中:Fe2+、Al3+、SO42-、I-.
=1012 的溶液中:Fe2+、Al3+、SO42-、I-.
A.①③⑥B.②④⑤C.②⑥D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
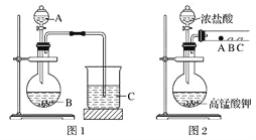
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com