
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
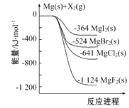
A. 热稳定性:MgF2>MgCl2>MgBr2>MgI2
B. 22.4LF2(g)与足量的Mg充分反应,放热1124kJ
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量
D. 由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H=-117kJ/mol
【答案】A
【解析】
A、物质的能量越低越稳定,易图象数据分析,化合物的热稳定性顺序为:MgF2>MgCl2>MgBr2>MgI2,选项A正确;
B、依据图象Mg(s)+F2(l)=MgF2(s) △H=-1124kJ/mol,但没有说明标准状况下,22.4LF2(g)不一定为1mol,选项B错误;
C、工业上可由电解熔融的MgCl2冶炼金属Mg,电解MgCl2溶液无法得到金属Mg,选项C错误;
D、依据图象Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ/mol,Mg(s)+Br2(g)=MgBr2(s)△H=-524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g)△H=-117kJmol-1,则MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H<-117kJ/mol,选项D错误;
答案选A。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:Ni(OH)2+OH-—e-=NiO(OH)+H2O
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
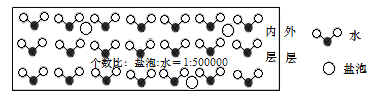
A.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
B.海冰内层“盐泡”越多,密度越小
C.海冰冰龄越长,内层的“盐泡”越少
D.若冰的密度为0.9g·cm﹣3,则海冰内层NaCl的浓度约为10-4mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、③Na2O2、⑨Cu,请你指出(填写序号):
属于碱性氧化物的是___;能导电的是___。
(2)胶体粒子直径在___nm之间
Ⅱ.化学计量在化学中占有重要地位。根据计算填空:
(1)实验室某浓盐酸的质量分数为36.5%,密度为1.20g·cm-3,此浓盐酸的物质的量浓度是___mol·L-1;
(2)6.8gH2O2与标准状况下___LCO2所含氧原子数相同;
Ⅲ.除去Mg粉中的Al粉,指明应加入的试剂,写出有关的离子反应方程式。
Mg粉(Al粉):试剂___,离子方程式____。
IV.配平如下方程式
___NaClO+___NH3·H2O=___N2H4+___NaCl+___H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出的新型高效光催化剂能利用太阳能分解水制取氢气,主要过程如图所示,下列说法正确的是( )
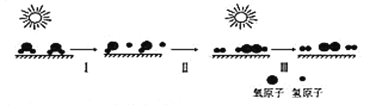
A. 与电解相比,光解水过程中消耗的能量较低
B. 过程I、Ⅱ都要吸收能量
C. 过程Ⅱ既有极性键形成,又有非极性键形成
D. 利用膜分离技术分离氢气和氧气具有良好的应用前景
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.

(1)该浓盐酸中HCl的物质的量浓度为 ______ molL-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______ .
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次并在操作步骤空白处填上适当仪器名称) ______ .
A.用30mL水洗涤 ______ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 ______ 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括 号内填“偏大”,“偏小”,或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面 ______
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)常作供氢剂,遇水蒸气剧烈反应。某小组设计如下实验制备氢化钙。下列说法错误的是( )
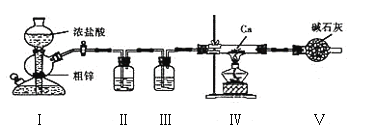
A. 装置I不可用于二氧化锰与浓盐酸反应制取氯气
B. 装置III、V所起作用相同
C. 直玻璃管加热前,用试管在末端收集气体并验纯
D. 试验结束后,可通过取样加水,根据气泡判断是否有CaH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
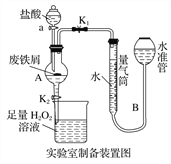
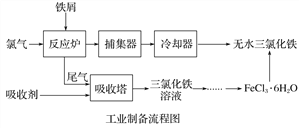
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com