
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
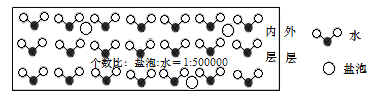
A.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
B.海冰内层“盐泡”越多,密度越小
C.海冰冰龄越长,内层的“盐泡”越少
D.若冰的密度为0.9g·cm﹣3,则海冰内层NaCl的浓度约为10-4mol·L﹣1
【答案】CD
【解析】
A.NaCl是离子化合物,不存在NaCl分子,A错误;
B.NaCl的式量大于H2O的相对分子质量,而且体积小,所以盐泡的密度比水大,海冰内层“盐泡”越多,密度越大,B错误;
C.根据题干信息,若海冰的冰龄达到1年以上,融化后的水为淡水,说明其中盐泡不再存在,因此海冰冰龄越长,内层的“盐泡”越少,C正确;
D.若冰的密度为0.9g·cm-3,则每1L冰的质量为900g,假设其中含有NaCl的物质的量是x,则海冰中含有H2O的物质的量是5×105xmol,58.5x+5×105xmol×18=900g,解得x=10-4mol,所以海冰内层NaCl的浓度约为10-4mol·L﹣1,D正确;
故合理选项是CD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。

(1)试管中发生的化学反应方程式是____________________________。
(2)指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)____________。
(3)烧杯中发生反应的离子方程式是_______________________________。
(4)如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为______________,加CaCl2后反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着含氮元素不同物质间的转化,实现氮按照一定的方向转化一直是科学领域研究的重要课题。氮气在催化剂作用下的一系列转化如图所示:
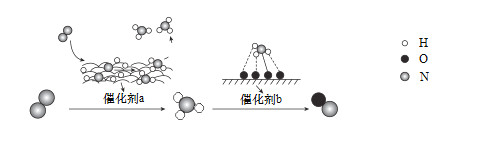
下列叙述正确的是
A.N2转化为NH3、NH3转化为NO均属于氮的固定
B.在催化剂a的作用下,氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.催化剂a、b均可以提高单位时间内反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
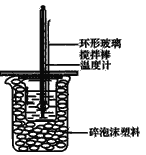
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是___(填“偏高”、“偏低”或“无影响”)。
(2)如果改用60mL1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量___(填“增加”、“减少”或“不变”),所求中和热数值___(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是____;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
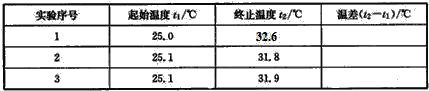
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3kJ/(g.℃),则该反应的中和热为△H=____(保留小数点后一位)。
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、M的原子序数依次增大。元素X和铝在元素周期表中具有特殊的“对角线”关系,单质及化合物的性质十分相似;Y原子半径在短周期主族元素中最大;Z元素有多种同素异形体,其中一种为正四面体结构,易自燃;M基态原子未成对电子数在同周期元素中最多。
请回答下列问题:
(1)元素Z在周期表中的位置是_______。
(2)元素X的氧化物能与Y的氧化物的水化物形成的溶液反应,生成一种四配位化合物,写出该化合物的化学式________。
(3)元素Y的氢化物被称作“万能还原剂”,具有强的还原性。其电子式为______,遇水可发生反应的化学方程式为________。
(4)元素M的名称为_______,其+3价氧化物与铝反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为原料制取高纯H2是重要的研究方向。回答下列问题:
(1)甲醇水蒸气重整制氢主要发生以下两个反应。
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49kJ·mol-1
CO2(g)+3H2(g) △H=+49kJ·mol-1
副反应:H2(g)+CO2(g) ![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为__________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②适当增大水醇比[n(H2O):n(CH3OH)],有利于甲醇水蒸气重整制氢,理由是___________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________(忽略副反应)。
(2)工业上常用CH4与水蒸气在一定条件下来制取H2,其反应原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
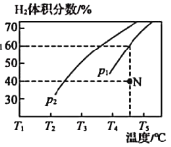
压强为p1时,在N点:v正_______v逆(填“大于”“小于”或“等于”),N点对应温度下该反应的平衡常数K=________mol2·L-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
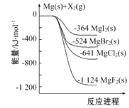
A. 热稳定性:MgF2>MgCl2>MgBr2>MgI2
B. 22.4LF2(g)与足量的Mg充分反应,放热1124kJ
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量
D. 由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H=-117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。
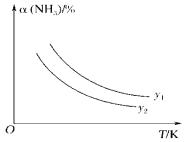
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH________(填“>”、“<”或“=”,下同)0,若y表示压强,则y1________y2,若y表示反应开始时的n(NH3)/n(CO2),则y1________y2。
(2)T℃时,若向容积为2L的恒容密闭容器中加入3mol NH3和1mol CO2,达到平衡时,容器内压强为开始时的3/4。若保持条件不变,再向该容器中加入0.5mol CO2和1mol H2O,NH3的转化率将________(填“增大”、“减小”或“不变”)。
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为285.8kJ·mol-1、726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为_____。
(4)如图是某甲醇燃料电池工作的示意图。
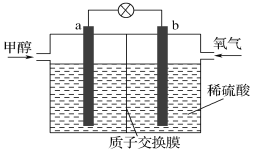
质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应为____,当电池中有1mol e-发生转移时左右两侧溶液的质量之差为_____ g(假设反应物耗尽,忽略气体的溶解)。
(5)写出Na2CO3溶液中各离子浓度的大小关系__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com