
【题目】50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
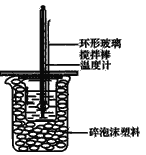
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是___(填“偏高”、“偏低”或“无影响”)。
(2)如果改用60mL1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量___(填“增加”、“减少”或“不变”),所求中和热数值___(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是____;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
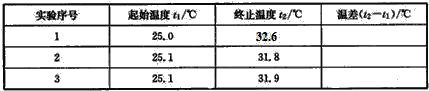
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3kJ/(g.℃),则该反应的中和热为△H=____(保留小数点后一位)。
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
【答案】偏低 增加 不变 H2SO4与Ba(OH)2反应生成的BaSO4沉淀时也有能量变化(或放热) -56.5kJ/mol a、c、d
【解析】
(1)环形铜棒是热的良导体,会使热量损失;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化,影响测定结果;
(4)先判断三次反应温度差的有效性,然后求出平均值,根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
(5)a.实验装置保温、隔热效果差,热量散失较大;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较大;
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度,HCl溶液的起始温度偏高;
(1)偏低;环形铜棒是热的良导体,其导热效果好于环形玻璃搅拌棒,会有一部分热量散失,求得的中和热数值将会减小;
(2)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL1.0molL-1盐酸跟50mL1.1molL-1氢氧化钠溶液进行反应,与上述实验相比,生成水的物质的量增多,所放出的热量增加,但是中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关;
(3)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热;
(4)3次反应前后温度差分别为:7.6℃、6.7℃、6.8℃,第一组舍去,平均值为6.75℃,50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液的质量和m=100mL×1g/mL=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.184J/(g℃)×100g×6.75℃=2.8224kJ,即生成0.05mol的水放出热量2.8224kJ,所以生成1mol的水放出热量为2.8224kJ×20=56.5kJ,即该实验测得的中和热△H=56.5kJ/mol;
故答案为:56.5kJ/mol;
(5)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有盐酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有盐酸的小烧杯中,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度,HCl溶液的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确。
故答案为:acd.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
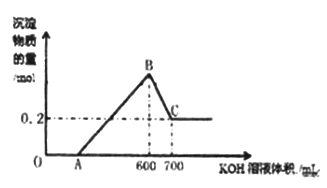
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1 molH—H键吸收436 kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1 molH—Cl键放出431 kJ能量。
H2+Cl2===2HCl的化学反应可用如图表示:
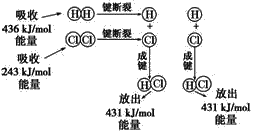
请回答下列有关问题:
(1)反应物断键吸收的总能量为____。
(2)生成物成键放出的总能量为____。
(3)1molH2和1molCl2反应生成2molHCl是_____(填“吸收”或“放出”)能量的反应,其能量值为____。
(4)反应物总能量___(填“>”或“<”)生成物总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因有( )
A.NaOH固体放在滤纸上称量
B.NaOH固体中混有Na2O杂质
C.摇匀后发现液面低于刻度线,加水至刻度线
D.有少量NaOH溶液残留在烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
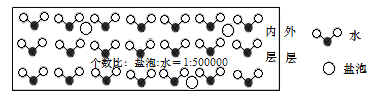
A.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
B.海冰内层“盐泡”越多,密度越小
C.海冰冰龄越长,内层的“盐泡”越少
D.若冰的密度为0.9g·cm﹣3,则海冰内层NaCl的浓度约为10-4mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.069![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成![]() 的物质的量的关系的是
的物质的量的关系的是
A.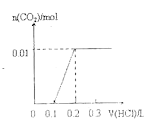 B.
B.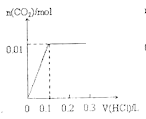
C.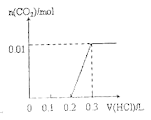 D.
D.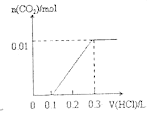
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出的新型高效光催化剂能利用太阳能分解水制取氢气,主要过程如图所示,下列说法正确的是( )
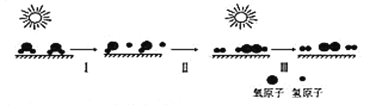
A. 与电解相比,光解水过程中消耗的能量较低
B. 过程I、Ⅱ都要吸收能量
C. 过程Ⅱ既有极性键形成,又有非极性键形成
D. 利用膜分离技术分离氢气和氧气具有良好的应用前景
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:
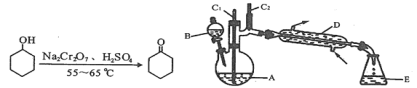
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为_______________;
②蒸馏不能分离环己酮和水的原因是______________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.往液体中加入NaCl固体至饱和,静置,分液;
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层;
c.加人无水MgSO4固体,除去有机物中少量的水;
d.过滤;
e.蒸馏、除去乙醚后,收集151~156℃馏分。
①B中水层用乙醚萃取的目的是_________;
②上述操作a、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__,操作a中,加入NaC1固体的作用是____。
③恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率为_____。(计算结果精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com