
【题目】将0.4gNaOH和1.069![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成![]() 的物质的量的关系的是
的物质的量的关系的是
A.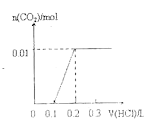 B.
B.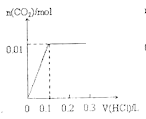
C.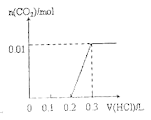 D.
D.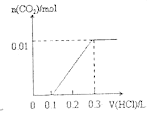
科目:高中化学 来源: 题型:
【题目】下列反应进行分类时,既属于氧化还原反应又属于置换反应的是 ( )
A. CH4+2O2![]() CO2+2H2O B. 2KClO3
CO2+2H2O B. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C. S+O2![]() SO2 D. 8NH3+3Cl2=6NH4Cl+N2↑
SO2 D. 8NH3+3Cl2=6NH4Cl+N2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是配制100mL2mol·L-1的NaOH的溶液过程示意图:
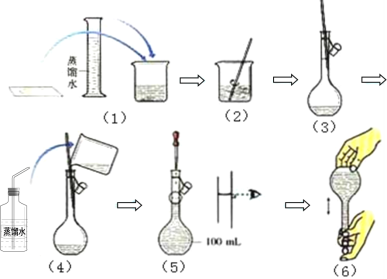
(1)步骤(3)(4)(5)(6)都涉及同一仪器,此仪器的名称为___。
(2)配制此溶液时,需称取NaOH固体的质量为___g。
(3)步骤(6)操作后,发现液面下降,这时___(填“需要”或“不需要”)再加水至刻度线。
(4)实验时,如果没有步骤(4)的操作,所得溶液的物质的量浓度将___;定容时俯视刻度会导致浓度___(填“偏高”“不变”或“偏低)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
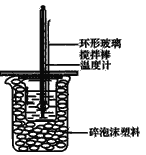
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是___(填“偏高”、“偏低”或“无影响”)。
(2)如果改用60mL1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量___(填“增加”、“减少”或“不变”),所求中和热数值___(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是____;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
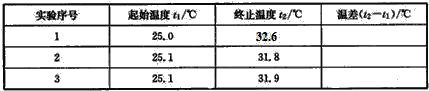
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3kJ/(g.℃),则该反应的中和热为△H=____(保留小数点后一位)。
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已达到平衡的可逆反应,增大压强后,反应速率(v)变化如图所示。该反应是

A. N2(g)+3H2(g) ![]() 2NH3(g)B. C(s)+H2O(g)
2NH3(g)B. C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
C. H2(g)+I2(g) ![]() 2HI(g)D. Fe3+(aq)+3SCN-(aq)
2HI(g)D. Fe3+(aq)+3SCN-(aq) ![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为原料制取高纯H2是重要的研究方向。回答下列问题:
(1)甲醇水蒸气重整制氢主要发生以下两个反应。
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49kJ·mol-1
CO2(g)+3H2(g) △H=+49kJ·mol-1
副反应:H2(g)+CO2(g) ![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为__________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②适当增大水醇比[n(H2O):n(CH3OH)],有利于甲醇水蒸气重整制氢,理由是___________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________(忽略副反应)。
(2)工业上常用CH4与水蒸气在一定条件下来制取H2,其反应原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
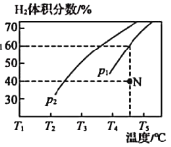
压强为p1时,在N点:v正_______v逆(填“大于”“小于”或“等于”),N点对应温度下该反应的平衡常数K=________mol2·L-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
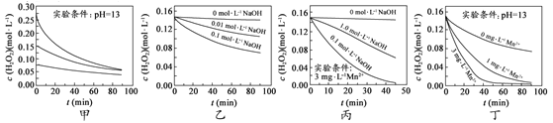
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。

则:①写出下列物质的化学式:
丙__________,B____________,C__________, D____________。
②写出甲跟乙反应的化学方程式:__________________________。
③单质丙与溶液乙反应生成气体B的离子方程式:___________________。
(2)如图是各物质的反应关系图:已知A和E都是黄色粉末,F有刺激性气味且有漂白性。请据此回答下列问题:

写出图中编号的化学方程式:
①_______________________;
②_______________________;
③______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com